题目内容
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
| A、少量Na2SO4固体,v(H2)不变 |
| B、VmLNa2SO4溶液,v(H2)增大 |
| C、将稀硫酸改为浓硫酸,v(H2)增大 |
| D、VmL稀硝酸,v(H2)增大 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:对应锌与稀硫酸的反应,增大固体表面积,适当增大稀硫酸浓度、升高温度以及形成原电池反应等,都可增大反应速率,注意浓硫酸、硝酸的性质,以此解答.
解答:
解:A.少量Na2SO4固体,不参与反应,浓度不变,则反应速率不变,故A正确;
B.加入Na2SO4溶液,溶液体积增大,浓度减小,则v(H2)减小,故B错误;
C.将稀硫酸改为浓硫酸,因浓硫酸具有强氧化性,与锌反应不生成氢气,故C错误;
D.稀硝酸与锌反应不生成氢气,故D错误.
故选A.
B.加入Na2SO4溶液,溶液体积增大,浓度减小,则v(H2)减小,故B错误;
C.将稀硫酸改为浓硫酸,因浓硫酸具有强氧化性,与锌反应不生成氢气,故C错误;
D.稀硝酸与锌反应不生成氢气,故D错误.
故选A.
点评:本题考查影响化学反应速率的因素,注意温度、浓度、压强、接触面积、原电池反应等对反应速率的影响即可解答,难度不大.

练习册系列答案
相关题目
下列实验操作中,正确的是( )
| A、除去苯中的少量苯酚:加入浓溴水然后过滤 |
| B、在稀氨水中逐渐加入稀的硝酸银溶液来配制银氨溶液 |
| C、向NaOH溶液中滴加少量CuSO4溶液,来配制新制Cu(OH)2 |
| D、溴乙烷在氢氧化钠存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A、禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
| B、过度开采矿物资源,促进地方经济发展 |
| C、改进汽车尾气净化技术,减少大气污染物的排放 |
| D、开发利用可再生能源,减少化石燃料的使用 |
下列反应中,既属于氧化还原反应,又是放热反应的是( )
| A、浓硫酸溶于水 |
| B、盐酸与氢氧化钠的反应 |
| C、灼热的碳与水蒸气的反应 |
| D、碳在少量氧气中反应生成一氧化碳 |
下面有关氧化还原反应的叙述中,正确的是( )
| A、在反应中不一定所有元素的化合价都发生变化 |
| B、非金属单质在反应中只作氧化剂 |
| C、肯定有一种元素被氧化,另一种元素被还原 |
| D、金属原子失电子越多,其还原性越强 |
室温下,在PH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的C(OH-)的数据分别为甲:1.0×10-7mol.L-1;乙:1.0×10-6mol.L-1;丙:1.0×10-2mol.L-1;丁:1.0×10-12mol.L-1.其中你认为可能正确的数据是( )
| A、甲、乙 | B、乙、丙 |
| C、丙、丁 | D、乙、丁 |
下列物质与其用途完全符合的是( )
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
在恒温恒容条件下,一定能使反应A(g)+B(s)?C(g)+D(g)的反应速率增大的措施是( )
| A、减小A或B的用量 |
| B、减小C的量 |
| C、增大B的量 |
| D、增大D的量 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
C、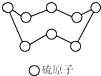 32g硫(结构见图)含S-S的数目为NA 32g硫(结构见图)含S-S的数目为NA |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |