题目内容
8.某无色溶液中含有K+,Cl-,OH-,SO32-,SO42-,为了检验除OH-外的其它所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象: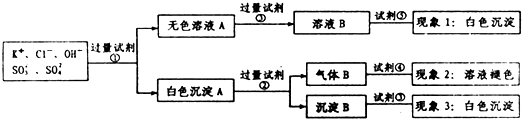
下列有关结论错误的是( )
| A. | 试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 试剂②是盐酸,试剂③是硝酸 | |
| D. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- |
分析 要检验SO32-、SO42-和Cl-,需要先加入试剂分离氯离子与亚硫酸根离子、硫酸根离子,然后分别检验氯离子、亚硫酸根离子和氯离子,所以试剂①为Ba(NO3)2溶液,无色溶液A为含有氢氧根离子和氯离子等混合液,加入硝酸银前必须将溶液中和,使用的是硝酸,不能够使用盐酸,所以试剂③为硝酸,试剂⑤为检验氯离子的硝酸银溶液;白色沉淀A为亚硫酸钡和硫酸钡的混合物,可以加入试剂②稀盐酸,亚硫酸钡沉淀溶解,生成了二氧化硫气体,再加入溴水具有生成的气体为二氧化硫;白色沉淀B不溶于盐酸和试剂③硝酸,以此解答该题.
解答 解:要检验SO32-、SO42-和Cl-,需要先加入试剂分离氯离子与亚硫酸根离子、硫酸根离子,然后分别检验氯离子、亚硫酸根离子和氯离子,所以试剂①为Ba(NO3)2溶液,无色溶液A为含有氢氧根离子和氯离子等混合液,加入硝酸银前必须将溶液中和,使用的是硝酸,不能够使用盐酸,所以试剂③为硝酸,试剂⑤为检验氯离子的硝酸银溶液;白色沉淀A为亚硫酸钡和硫酸钡的混合物,可以加入试剂②稀盐酸,亚硫酸钡沉淀溶解,生成了二氧化硫气体,再加入溴水具有生成的气体为二氧化硫;白色沉淀B不溶于盐酸和试剂③硝酸,
A.试剂③用于排除其他能跟Ag+产生沉淀离子的干扰,使用的是硝酸溶液,不是硝酸银,故A错误;
B.根据以上分析可知,白色沉淀B为硫酸钡,故B正确;
C.试剂②用于溶解亚硫酸钡,硝酸检验氧化性,能够氧化亚硫酸钡,不能够使用硝酸,选用盐酸,试剂③证明白色沉淀为硫酸钡,使用的是硝酸,故C正确;
D.二氧化硫与溴单质反应,导致溴水褪色,反应的方程式为Br2+2H2O+SO2=4H++2Br-+SO42-,故D正确;
故选A.
点评 本题考查无机物的推断,侧重考查物质的检验以及实验方案的设计,题目难度中等,离子的检验是高中化学的重点知识,也是高考的热点之一,了解常见离子的化学性质是解答本题的关键;该题是高考中的高频题,侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案| A. | ④⑤ | B. | ②④⑤ | C. | ④⑤⑥ | D. | ③④⑤ |
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | X、Y分别与W形成的化合物都具有两性 | |
| B. | Z、W在同一主族 | |
| C. | 气态氢化物的稳定性为H2W<H2Z | |
| D. | X和Y对应的氢氧化物的碱性强弱比较:X(OH)2<Y(OH)3 |
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a>b+1 | |
| C. | pH=9的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>③>② | |
| D. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
| A. | 用焰色反应鉴別Na2CO3溶液和K2CO3溶液 | |
| B. | 用分液漏斗分离食醋中的乙酸与水 | |
| C. | 用丁达尔现象检验NaCl溶液中是否含有淀粉胶体 | |
| D. | 用NaOH溶液除去Cl2中混有的少量HCl |