题目内容
19.有下列物质:①甲烷;②苯;③聚乙烯;④乙烯;⑤乙炔;⑥甲苯既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )| A. | ④⑤ | B. | ②④⑤ | C. | ④⑤⑥ | D. | ③④⑤ |
分析 具有还原性的物质能够与酸性高锰酸钾溶液反应;含有碳碳双键或碳碳三键的有机物能够使溴水褪色,则既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,该有机物中含碳碳双键或三键,以此来解答.
解答 解:①甲烷与高锰酸钾、溴水均不反应;
②苯与高锰酸钾、溴水均不反应;
③聚乙烯中不含双键,与高锰酸钾、溴水均不反应;
④乙烯中含双键,与高锰酸钾、溴水均反应使其褪色;
⑤乙炔中含碳碳三键,与高锰酸钾、溴水均反应使其褪色;
⑥甲苯与溴水不反应,
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、炔烃等有机物及分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.如表实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A. | A | B. | B | C. | C | D. | D |
10.下列不能使有色布条褪色的是( )
| A. | 氯水 | B. | 次氯酸钠溶液 | C. | 漂白粉溶液 | D. | 氯化钙溶液 |
4.下列关于钠的化合物叙述中错误的是( )
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
11.下列说法正确的是( )
| A. | 聚氯乙烯的单体是CH2=CHCl | |
| B. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| C. | 聚乙烯的链节是CH2=CH2 | |
| D. | 聚乙烯的产量是衡量一个国家石油化工发展水平的标志 |
8.某无色溶液中含有K+,Cl-,OH-,SO32-,SO42-,为了检验除OH-外的其它所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
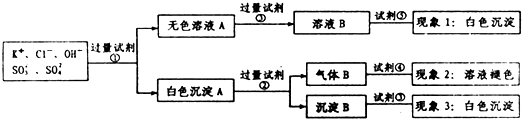
下列有关结论错误的是( )

下列有关结论错误的是( )
| A. | 试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 试剂②是盐酸,试剂③是硝酸 | |
| D. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- |
9.已知氯化钠和纯碱晶体的溶解度曲线如下:将碱从氯化钠和纯碱的混合物中分离出来,最好应用的方法是( )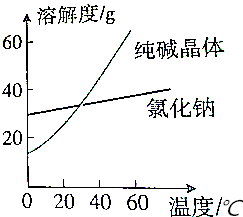

| A. | 蒸馏法 | B. | 苹取法 | C. | 结晶法 | D. | 分液法 |