题目内容
18.明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指( )| A. | 萃取 | B. | 蒸发 | C. | 蒸馏 | D. | 升华 |
分析 由信息可知,蒸令气上,则利用互溶混合物的沸点差异分离,以此来解答.
解答 解:由信息可知,蒸令气上,则利用互溶混合物的沸点差异分离,则该法为蒸馏,
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列各有机物中,属于烃的是( )
| A. | 氯丁烷 | B. | 苯 | C. | 硝基苯 | D. | 乙醇 |
9.如表实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A. | A | B. | B | C. | C | D. | D |
6.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol的白磷(P4)或CCl4中所含的共价键数均为0.4NA | |
| B. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| C. | 5.4gAl分别于含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移4 NA个电子 |
13.下列有关实验的说法正确的是( )
| A. | 向蛋白质溶液中滴加饱和Na2SO4溶液或浓硝酸均会产生白色沉淀,是因为蛋白质变性 | |
| B. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 | |
| C. | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水,石灰水变浑浊,该钾盐一定是K2CO3 | |
| D. | 进行K与水反应的实验操作:可在培养皿中放些水,然后取绿豆大小的钾,用滤纸吸干表面的煤油,投入培养皿中 |
3.下列关于弱电解质的说法中,正确的是( )
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子 |
10.下列不能使有色布条褪色的是( )
| A. | 氯水 | B. | 次氯酸钠溶液 | C. | 漂白粉溶液 | D. | 氯化钙溶液 |
8.某无色溶液中含有K+,Cl-,OH-,SO32-,SO42-,为了检验除OH-外的其它所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
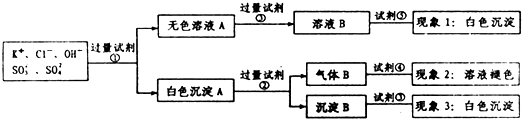
下列有关结论错误的是( )

下列有关结论错误的是( )
| A. | 试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 试剂②是盐酸,试剂③是硝酸 | |
| D. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- |