题目内容
20.用下列装置制SO2并进行产物性质险验和回收实验,能达到实验目的是( )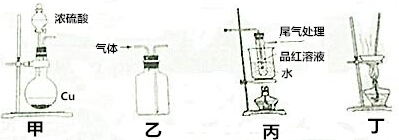
| A. | 用装置甲制取SO2 | |
| B. | 用装置乙制取SO2 | |
| C. | 用装置丙探究SO2与品红作用的可逆性 | |
| D. | 用装置丁蒸干硫酸铜溶液制得CuSO4•5H2O |
分析 A.浓硫酸与Cu反应加热;
B.乙可利用向上排空气法收集;
C.二氧化硫与品红化合生成无色物质,加热分解;
D.蒸干晶体失去结晶水.
解答 解:A.浓硫酸与Cu反应加热,图中缺少酒精灯,故A错误;
B.乙可利用向上排空气法收集,不能用于制备,故B错误;
C.二氧化硫与品红化合生成无色物质,加热分解,则装置丙可探究SO2与品红作用的可逆性,故C正确;
D.蒸干晶体失去结晶水,不能蒸干,应利用冷却结晶法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力、实验能力的考查,把握物质的制备实验、性质实验及装置的作用为解答的关键,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
5.NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,4.4g体积比为3:1的CO2和N2O组成的混合气体中所含原子总数为0.3NA | |
| B. | CH4与P4的分子结构均为正四面体形,在1molCH4或P4分子中含有共价键数皆为4NA | |
| C. | 含有NA个阴离子的Na2O溶于水形成1L的溶液中,溶质的物的质量浓度为1mol•L-1 | |
| D. | 标准状况下,5.6L18O2参加反应一定转移NA个e- |
18.在2L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).反应达平衡后,若再通入一定量CO2,则平衡常数K将不变,CO2的转化率减小.(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是$\frac{2}{3}$.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 600 | 800 | 830 | 1000 | 1200 |
| K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).反应达平衡后,若再通入一定量CO2,则平衡常数K将不变,CO2的转化率减小.(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是$\frac{2}{3}$.
19.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
| D | 向水玻璃溶液中通入足量CO2 后,产生白色浑浊 | 生成了硅酸沉淀 |
| A. | A | B. | B | C. | C | D. | D |
 .
.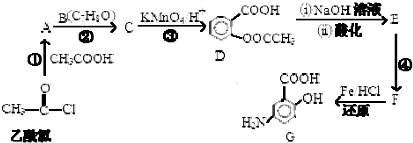
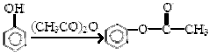 ,
, (具有还原性,极易被氧化)
(具有还原性,极易被氧化) .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式)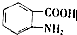 的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题: