题目内容
19.下列实验“操作和现象”与“结论”对应关系正确的是( )| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
| D | 向水玻璃溶液中通入足量CO2 后,产生白色浑浊 | 生成了硅酸沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NO3-在酸性条件下具有氧化性,被还原生成NO,NO被O2氧化为红棕色的NO2;
B.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应;
C.乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,SO2具有还原性,也可以使酸性KMnO4溶液褪色;
D.碳酸的酸性大于硅酸.
解答 解:A.向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A错误;
B.应加入碱将水解后的淀粉溶液调节成碱性,才可以产生红色沉淀,故B错误;
C.乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,也可以使酸性KMnO4溶液褪色,故C错误;
D.碳酸的酸性大于硅酸,强酸可制取弱酸,可生产硅酸沉淀,故D正确.
故选D.
点评 本题考查化学实验方案的评价,注意物质的性质和物质的检验方法,排除其它因素的干扰,注重相关基础知识的积累,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.用下列装置制SO2并进行产物性质险验和回收实验,能达到实验目的是( )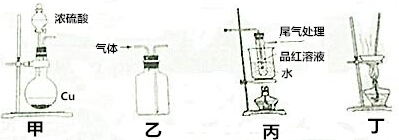

| A. | 用装置甲制取SO2 | |
| B. | 用装置乙制取SO2 | |
| C. | 用装置丙探究SO2与品红作用的可逆性 | |
| D. | 用装置丁蒸干硫酸铜溶液制得CuSO4•5H2O |
10.下列化合物中能发生银镜反应,不能发生水解反应的有( )
| A. |  | B. |  | C. |  | D. |  |
7.下列实验的有关叙述错误的是( )
| 选项 | A | B | C | D |
| 实验装置图 |  | 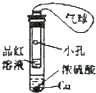 |  | 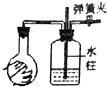 |
| 实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
| 实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验的操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
11.下列各组离子中,在溶液中能大量共存的是( )
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
8.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:
(1)能形成共价键的元素有H、He、C、N、O、F、S、Cl元素,共8种.
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.

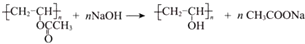
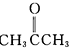 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是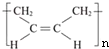 .
.