题目内容
欲增加Mg(OH)2在水中的溶解度,可采用的方法是( )
| A、增加溶液pH |
| B、加入2.0mol?L-1 NH4Cl |
| C、加入0.1mol?L-1 MgSO4 |
| D、加入适量95%乙醇 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:改变物质的溶解度要考虑溶解度的影响因素,Mg(OH)2在水中存在沉淀溶解平衡,所以要根据沉淀溶解平衡的影响因素分析,选择合适的改变溶解度的方法.
解答:
解:A、增大溶液pH值,溶液中c(OH-)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,故A错误;
B、加入2.0 mol?L-1NH4Cl,由于NH4+与OH-结合使溶液中c(OH-)减小,Mg(OH)2的溶解平衡正移,溶解度增大,故B正确;
C、加入0.1 mol?L-1MgSO4,c(Mg2+)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,故C错误;
D、加入适量95%乙醇,对Mg(OH)2在水中的溶解度无影响,故D错误;
故选B.
B、加入2.0 mol?L-1NH4Cl,由于NH4+与OH-结合使溶液中c(OH-)减小,Mg(OH)2的溶解平衡正移,溶解度增大,故B正确;
C、加入0.1 mol?L-1MgSO4,c(Mg2+)增大,Mg(OH)2的溶解平衡逆移,溶解度降低,故C错误;
D、加入适量95%乙醇,对Mg(OH)2在水中的溶解度无影响,故D错误;
故选B.
点评:本题考查了影响沉淀溶解平衡的因素,题目难较小.

练习册系列答案
相关题目
下列电离方程式中,正确的是( )
| A、H2SO4═H2++SO42- |
| B、HClO═H++ClO- |
| C、MgCl2═Mg2++2Cl- |
| D、Ba(OH)2═Ba2++OH- |
有关AgCl沉淀的溶解平衡的说法正确的是( )
| A、向AgCl饱和溶液中加入NaCl固体,AgCl的Ksp增大 |
| B、AgCl不溶于水,溶液中没有Cl-和Ag+ |
| C、AgCl沉淀的生成和溶解仍在不断进行,但速率相等 |
| D、向AgCl饱和溶液中加入NaCl固体,没有AgCl产生 |

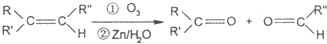
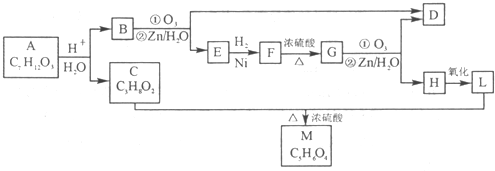
 研究NO2、SO2、NO、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、NO、CO等大气污染气体的处理具有重要意义.
