题目内容
2.2013年诺贝尔化学奖授予三位美国科学家,以表彰他们如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应.(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有abc(不定项选择).
a.每个C2H2和C2H4分子中的π键数目相同
b.碳负离子CH3-呈三角锥形
c.NO+电子式为[:N??O:]+
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极,也可人工合成二价钒(V)固氮酶(结构如图1)
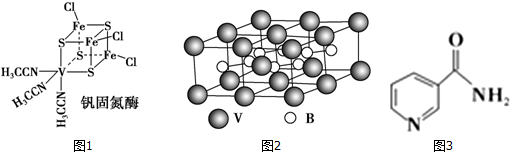
①V元素位于周期表的d区,该原子基态时的价层电子排布式为3d34s2.
②钒固氮酶中钒的配位原子有N、S(写元素符号).
③熔融空气电池钒硼晶体晶胞结构如图2所示,该晶胞中含有钒原子数目为4.
(3)烟酰胺(结构简式如图3)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有sp2、sp3,1mol该分子中含σ键的数目为15mol或15×6.02×1023.
分析 (1)a.正负电荷重心重合的分子为非极性分子;
b.根据价层电子对互斥理论确定其空间构型;
c.NO+和氮气分子属于等电子体,等电子体结构相似;
d.NH3中氢键导致氨气熔沸点较高;
(2)①V是23号元素,V原子电子排布式为1s22s22p63s23p63d34s2,所以是第四周期ⅤB族,该原子基态时的价层电子排布式为3d34s2;
②V含有空轨道、N原子和S原子含有孤电子对,V和N原子、S原子之间存在配位键;
③利用均摊法计算该晶胞中含有钒原子数目;
(3)环上N原子含有2个σ键和一个孤电子对,氨基上N原子含有3个σ键和1个孤电子对,据此判断N原子杂化方式,l个该分子中含σ键数目为15,据此计算lmol该分子中含σ键数目.
解答 解:(1)a.正负电荷重心重合的分子为非极性分子,C2H2、C2H4结构对称且正负电荷重心重合,所以是非极性分子,故正确;
b.碳负离子CH3-价层电子对个数=3+$\frac{1}{2}$(4+1-3×1)=4且含有一个孤电子对,所以为三角锥形,故正确;
c.NO+和氮气分子属于等电子体,等电子体结构相似,所以NO+电子式为 ,故正确;
,故正确;
d.NH3中含有氢键、N2中不含氢键,NH3中氢键导致氨气熔沸点较高,故错误;
故选abc;
(2)①V是23号元素,V原子电子排布式为1s22s22p63s23p63d34s2,所以是第四周期ⅤB族,最后一个电子排在3d上,所以在d区,该原子基态时的价层电子排布式为3d34s2,故答案为:d;3d34s2;
②根据图知,V含有空轨道、N原子和S原子含有孤电子对,V和N原子、S原子之间存在配位键,故答案为:N、S;
③根据图片知,该晶胞中含有钒原子数目=2×$\frac{1}{2}$+8×$\frac{1}{4}$+8×$\frac{1}{8}$=4,故答案为:4;
(3)环上N原子含有2个σ键和一个孤电子对,氨基上N原子含有3个σ键和1个孤电子对,所以环上N原子采用sp2杂化,氨基上N原子采用杂化sp3,l个该分子中含σ键数目为15,所以lmol该分子中含σ键数目为15mol或15×6.02×1023,故答案为:sp2、sp3;15mol或15×6.02×1023.
点评 本题考查了物质结构和性质,涉及原子杂化方式的判断、核外电子排布式的书写、配位键、晶胞的计算等知识点,利用价层电子对互斥理论、构造原理、配位键概念、均摊法等知识点来分析解答,这些知识点都是考试高频点,熟练掌握这些知识解答问题.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案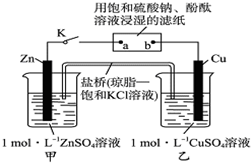
| A. | 电子沿Zn→a→b→Cu路径流动 | B. | Cu电极上发生氧化反应 | ||
| C. | 片刻后可观察到滤纸a点变红色 | D. | 片刻后甲池中c(SO42-)增大 |
| A. | 每生成2molHCl放出179kJ热量 | B. | 每生成1molHCl放出179kJ热量 | ||
| C. | 每生成2molHCl吸收179kJ热量 | D. | 每生成1molHCl吸收179kJ热量 |
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
| A. | 溴和苯 | B. | 苯和溴苯 | C. | 水和硝基苯 | D. | 苯和汽油 |
| A. | 2,3-二甲基丁烷 | B. | 2,5-二甲基-4-乙基己烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
| A. | 混合气体密度恒定不变 | B. | 消耗n mol H2同时生成2n mol HI | ||
| C. | H2、I2、HI的浓度相等 | D. | 混合气体的颜色不再改变 |
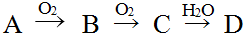
 ,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.