题目内容
15.下列事实不能证明醋酸是弱酸的是( )| A. | 常温下,测得醋酸钠溶液的pH>7 | |
| B. | 醋酸可以使紫色石蕊试液变红 | |
| C. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快 | |
| D. | 常温下,测得0.1 mol/L醋酸溶液的pH>1 |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.常温下,测得醋酸钠溶液的pH>7,说明醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则证明醋酸是弱酸,故A不选;
B.醋酸可以使紫色石蕊试液变红色,说明醋酸电离出氢离子而使溶液呈酸性,但不能说明醋酸是否部分电离,所以不能证明醋酸是弱电解质,故B选;
C.物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快,说明盐酸中氢离子浓度大于醋酸,二者都是一元酸,HCl是强电解质,则醋酸是弱电解质,故C不选;
D.常温下,测得0.1 mol/L醋酸溶液的pH>1,醋酸中氢离子浓度小于醋酸浓度,说明醋酸部分电离,为弱电解质,故D不选;
故选B.
点评 本题考查弱电解质的判断,为高频考点,强弱电解质的根本区别是电离程度,与其溶液导电性强弱、溶解性强弱等都无关,注意把握实验原理和角度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列反应属于吸热反应的是( )
| A. | 镁与盐酸反应 | B. | 氢氧化钠与盐酸反应 | ||
| C. | 碳与二氧化碳在高温下反应 | D. | 硫在空气或氧气中燃烧 |
7.下列离子方程式正确的是( )
| A. | 钠和水的反应Na+H2O=Na++OH-+H2↑ | |
| B. | 氯气通入水中Cl2+H2O=2H++Cl-+ClO- | |
| C. | 小苏打溶液中加入过量的石灰水Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 碳酸钙和醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
4.下列实验装置或操作正确的是( )
| A. |  除去Cl2中混有的HCl | B. |  用浓硫酸配制一定浓度的稀硫酸 | ||
| C. |  称量氢氧化钠固体 | D. |  实验室制备氨气 |
5.已知A、B、C、D均是气体,反应A+B?C+D的能量变化如图所示,下列说法正确的是( )


| A. | 反应物的总键能量低于生成物的总键能 | |
| B. | 该反应是放热反应 | |
| C. | 当A的正反应速率与C的逆反应速率相同时处于平衡状态 | |
| D. | 当A、B、C、D的浓度相同时,反应处于平衡状态 |
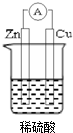 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答: