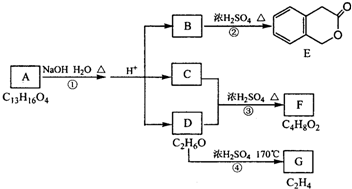
题目内容
在稀硫酸中加入铜粉,铜粉不溶解,再加入某X物质,发现铜粉逐渐溶解,问神秘的X不可能是( )
| A、FeCl3 |
| B、HNO3 |
| C、HCl |
| D、KNO3 |
考点:铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:根据铜的化学性质判断,如:铜不能与弱氧化性酸反应,但可以和强氧化性酸反应,能与具有氧化性的FeCl3溶液、酸性条件下的硝酸盐等反应.
解答:
解:A、铜能和氯化铁反应生成氯化亚铁和氯化铁,所以铜能在氯化铁溶液中溶解,故A不选;
B、根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故B不选;
C、稀硫酸中加入铜粉,铜粉不溶解,再加入HCl,铜仍然不溶解,故C选;
D、向稀硫酸反应加入硝酸钾后,溶液中含有氢离子和硝酸根离子,所以相当于溶液中含有硝酸,硝酸能和铜反应,所以加入硝酸钾后能溶解铜,故D不选.
故选C.
B、根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故B不选;
C、稀硫酸中加入铜粉,铜粉不溶解,再加入HCl,铜仍然不溶解,故C选;
D、向稀硫酸反应加入硝酸钾后,溶液中含有氢离子和硝酸根离子,所以相当于溶液中含有硝酸,硝酸能和铜反应,所以加入硝酸钾后能溶解铜,故D不选.
故选C.
点评:本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐,铜一样能被溶解.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
铜粉放入稀硫酸中,加热后无现象,当加入一点盐后,铜粉质量减少,新加入的盐可能是下列中的( )
| A、氯化物 | B、硫酸盐 |
| C、硝酸盐 | D、磷酸盐 |
下列叙述中正确的是( )
| A、常温下,10mlpH=12的氢氧化钠溶液中加入10mlpH=2的HA,所得溶液pH≤7 |
| B、25℃时,0.1mol/L与0.01mol/L的氯化铵溶液的pH前者大 |
| C、室温时浓度均为0.1mol/L的NH3?H2O和NH4Cl的混合液,pH为10,则,c(NH4+)+c(H+)<c(NH3?H2O)+c(OH-) |
| D、0.1mol/LNa2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3.铜粉可溶解的是( )
| A、①② | B、①④ | C、②③ | D、②④ |
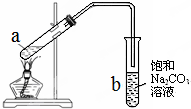 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B、实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| C、试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度 |
| D、试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
镁铝合金5.1g溶于300mL 2mol?L-1盐酸中,标准状况下放出气体体积为5.6L,向反应后的溶液中加入500mL NaOH溶液充分反应,最终产生白色沉淀.下列有关说法不正确的是( )
| A、5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g |
| B、溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
| C、生成白色沉淀的最大质量为13.6 g |
| D、若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol?L-1 |
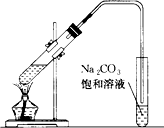 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.