题目内容
4.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:(1)写出N的原子结构示意图:
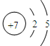 .
.(2)下列方法中,不能用来区分NaNO2和NaCl的是B(填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:NO2-+Cl2+H2O=NO3-+2H++2Cl-.
分析 (1)N的质子数为7,原子结构中最外层电子数为5;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.甲基橙的变色范围是3.1-4.4;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
(3)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应.
解答 解:(1)N的原子结构示意图为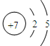 ,故答案为:
,故答案为: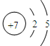 ;
;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2-+Cl2+H2O=NO3-+2H++2Cl-,
故答案为:NO2-+Cl2+H2O=NO3-+2H++2Cl-.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5mL0.1mol•L-1NaOH溶液后,两溶液中离子种类相同 |
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | 9 |
| 乙 | c1 | 0.2 | 7 |
| A. | 甲:反应后溶液中 c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 乙:反应后溶液中 c(Na+)=c(HA)+c(A-) | |
| C. | 甲中由水电离产生的c(H+)=1×10-9 mol•L-1 | |
| D. | 乙中c1一定大于0.2 mol•L-1 |
 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
 .
. .
.
 ;
; 生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中含氧量较多,燃烧过程电会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.
生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中含氧量较多,燃烧过程电会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀. .
. $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
 ,CH2=C(CH3)CH=CH2.
,CH2=C(CH3)CH=CH2.