题目内容
12.常温下,将某一元酸HA与NaOH溶液等体积混合,结果如下:| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | 9 |
| 乙 | c1 | 0.2 | 7 |
| A. | 甲:反应后溶液中 c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 乙:反应后溶液中 c(Na+)=c(HA)+c(A-) | |
| C. | 甲中由水电离产生的c(H+)=1×10-9 mol•L-1 | |
| D. | 乙中c1一定大于0.2 mol•L-1 |
分析 A.HA与NaOH等物质的量反应生成NaA,溶液显碱性,说明NaA为强碱弱酸盐;
B.根据电荷守恒分析;
C.NaA溶液中氢离子全部由水电离;
D.HA与NaOH等物质的量反应生成NaA,溶液显碱性,若溶液显中性,则NaOH的物质的量要减少.
解答 解:A.HA与NaOH等物质的量反应生成NaA,溶液显碱性,说明NaA为强碱弱酸盐,则A-发生水解浓度会减小,所以c(Na+)>c(A-),则甲:反应后溶液中 c(Na+)>c(A-)>c(OH-)>c(H+),故A正确;
B.乙:反应后溶液中存在电荷守恒,即 c(Na+)+c(H+)=c(OH-)+c(A-),溶液显中性,则c(H+)=c(OH-),所以c(Na+)=c(A-),故B错误;
C.甲中HA与NaOH等物质的量反应生成NaA,NaA溶液中氢离子全部由水电离,则溶液中由水电离产生的c(H+)=1×10-9 mol•L-1,故C正确;
D.HA与NaOH等物质的量反应生成NaA,溶液显碱性,若溶液显中性,则NaOH的物质的量要减少,所以HA的浓度大于NaOH的浓度,即乙中c1一定大于0.2 mol•L-1,故D正确.
故选B.
点评 本题考查较为综合,涉及了盐类水解、溶液中氢离子的计算、电荷守恒等知识,有一定的综合性,题目难度中等,侧重于学生的分析能力和计算能力的考查.

练习册系列答案
相关题目
7.配制一定体积、一定物质的量浓度的溶液,下列操作使配得的溶液浓度偏小的是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 定容时观察液面俯视 | |
| C. | 滴管加水时,有少量水滴到容量瓶外 | |
| D. | 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
4.常温下,HA和HB两种一元酸的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )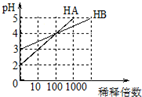

| A. | 向等体积等浓度的HA和HB溶液中滴加等浓度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀释HB酸溶液,则c(H+)/c(HB)减小 | |
| C. | 常温下,用pH=a的V1L HA酸与pH=b的V2L NaOH溶液混合,若a+b=14,则反应后溶液呈中性 | |
| D. | 若向等体积等pH的HB和HA酸溶液加入足量锌粉,均反应生成H2,最终HB生成的H2多 |
1.合成氨反应为N2+3H2?2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
2.某原子核外电子排布式为ns2np7,它违背了( )
| A. | 泡利原理 | B. | 能量最低原理 | C. | 洪特规则 | D. | 洪特规则特例 |
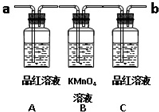 已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.
已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2. .
.