题目内容
氮是地球上含量丰富的元素之一.为了科学合理地利用氮元素,科学家一直致力于“人工固氮”新方法的研究.
(1)目前有关人工固氮的主要反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
①已知:N≡N的键能是942kJ?mol-1,H-H的键能是431.2kJ?mol-1,则N-H的键能是 kJ?mol-1
②某研究小组在400℃、30MPa下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.从开始到平衡时,反应的平均速率H2的浓度变化表示v(H2)= .
③在下列措施中,既能加快合成氨化学反应速率,又能提高原料转化率的是 .
A.向密闭容器中按原比例再充入原料气 B.向密闭容器中再充入稀有气体
C.缩小容器的体积,增大反应体系的压强D.将氨气液化并及时分离出去
(2)据报道,在常温、常压、光照、催化剂的条件下,N2也可以与水直接反应生成氨气和氧气,从而实现氮的固定.又已知:2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ?mol-1,则反应2N2(g)+6H2O(l)?4NH3(g)+3O2(g)的△H= kJ?mol-1.
(1)目前有关人工固氮的主要反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
①已知:N≡N的键能是942kJ?mol-1,H-H的键能是431.2kJ?mol-1,则N-H的键能是

②某研究小组在400℃、30MPa下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.从开始到平衡时,反应的平均速率H2的浓度变化表示v(H2)=
③在下列措施中,既能加快合成氨化学反应速率,又能提高原料转化率的是
A.向密闭容器中按原比例再充入原料气 B.向密闭容器中再充入稀有气体
C.缩小容器的体积,增大反应体系的压强D.将氨气液化并及时分离出去
(2)据报道,在常温、常压、光照、催化剂的条件下,N2也可以与水直接反应生成氨气和氧气,从而实现氮的固定.又已知:2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ?mol-1,则反应2N2(g)+6H2O(l)?4NH3(g)+3O2(g)的△H=
考点:有关反应热的计算,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①反应物总键能-生成物总键能=反应热,据此计算;
②根据化学反应速率v=
来计算;
③根据影响化学反应速率和化学平衡移动的因素来回答;
(2)根据盖斯定律来计算化学反应的焓变.
②根据化学反应速率v=
| △c |
| △t |
③根据影响化学反应速率和化学平衡移动的因素来回答;
(2)根据盖斯定律来计算化学反应的焓变.
解答:
解:(1)①根据N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,设N-H的键能是x,则942kJ?mol-1+3×431.2kJ?mol-1-2x=-92.4kJ?mol-1,解得x=388kJ?mol-1,
故答案为:388;
②根据化学反应速率v=
=
=
mol/(L?s),故答案为:
mol/(L?s);
③A.向密闭容器中按原比例再充入原料气,相当于增大压强,可以加快合成氨化学反应速率,又能使平衡右移,提高原料转化率,故A正确;
B.向密闭容器中再充入稀有气体,各个组分浓度不变,化学反应速率不变,化学平衡不移动,故B错误;
C.缩小容器的体积,增大反应体系的压强,可以加快合成氨化学反应速率,又能使平衡右移,提高原料转化率,故C正确;
D.将氨气液化并及时分离出去,可以减慢反应速率,使化学平衡正向移动,提高原料转化率,故D错误.
故答案为:AC;
(2)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1;②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ?mol-1,根据盖斯定律,反应2N2(g)+6H2O(l)?4NH3(g)+3O2(g)可以是①×2-3×②得到,即反应的焓变)△H=(-92.4kJ?mol-1)×2-3(-571.6kJ?mol-1)=1530kJ?mol-1.
故答案为:1530.
故答案为:388;
②根据化学反应速率v=
| △c |
| △t |
| ||
| t2 |
| 3n2 |
| 2Vt2 |
| 3n2 |
| 2Vt2 |
③A.向密闭容器中按原比例再充入原料气,相当于增大压强,可以加快合成氨化学反应速率,又能使平衡右移,提高原料转化率,故A正确;
B.向密闭容器中再充入稀有气体,各个组分浓度不变,化学反应速率不变,化学平衡不移动,故B错误;
C.缩小容器的体积,增大反应体系的压强,可以加快合成氨化学反应速率,又能使平衡右移,提高原料转化率,故C正确;
D.将氨气液化并及时分离出去,可以减慢反应速率,使化学平衡正向移动,提高原料转化率,故D错误.
故答案为:AC;
(2)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1;②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ?mol-1,根据盖斯定律,反应2N2(g)+6H2O(l)?4NH3(g)+3O2(g)可以是①×2-3×②得到,即反应的焓变)△H=(-92.4kJ?mol-1)×2-3(-571.6kJ?mol-1)=1530kJ?mol-1.
故答案为:1530.
点评:本题综合考查学生热化学、化学反应速率和平衡移动等方面的知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
质量相同的两种气体A、B,在同温同压下,A的密度小于B,下列说法错误的是( )
| A、A的体积比B大 |
| B、A的摩尔质量比B大 |
| C、A的分子数比B多 |
| D、A的物质的量比B大 |
据图判断下列说法不正确的是( )
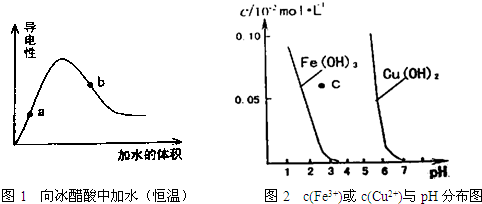

| A、图1中醋酸电离平衡常数:a点的比b点的小 |
| B、图1中醋酸溶液的pH:a点的比b点的大 |
| C、图2中c点对应的溶液为Fe(OH)3的不饱和溶液 |
| D、由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调PH约为4左右 |
常温下,下列有关叙述正确的是( )
| A、pH=6的酸性溶液中,可能存在NH3?H2O分子 |
| B、由水电离出来的C(H+)=10-12mol/L的溶液中,Al3+不可能大量存在 |
C、酸性溶液中,可能大量存在Fe3+、SO42-、Na+, |
| D、常温下,C(H+)=0.1mol?L?1的溶液中可能大量存在NO3-、Na+、I-、K+ |
NA代表阿伏德罗常数,下列叙述正确的是( )
| A、1mol/L Na2CO3溶液中的Na+数目为2NA |
| B、常温常压下,46gNO2的原子数为3NA |
| C、电解Na2CO3饱和溶液,若生成2NA个H2,一定生成2NA个O2 |
| D、1molNa2O2与H2O完全反应时转移的电子数为2NA |
重金属离子具有毒性.在珠三角某地有甲、乙两个厂排放的重金属离子的废液,甲厂废液经化验主要含有毒的Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙厂废液中可能含有的离子是( )
| A、Cu2+和SO42- |
| B、Cu2+和Cl- |
| C、K+和SO42- |
| D、Ag+和NO3- |
 FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.