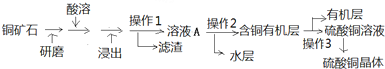
题目内容
x、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表
(1)X、Y、Z、W中属于主族元素,且原子半径最小的元素在周期表中的位置是 .
(2)Y原子的最外层电子排布式是 ;Y的最高价氧化物与NaOH溶液反应的化学方程式是 .
(3)与X同周期相邻元素的第一电离能由大到小的顺序是 (填元素符号).
(4)X、Y的最高价氧化物中熔点较高的是 (填化学式).
(5)根据W的价电子排布式,推出W的氧化物有2种,其化学式分别是 ;将一种氧化物加入稀硫酸中,溶液变蓝色,且析出紫红色固体,写出有关的离子方程式 .
| 元素 | 相关信息 |
| X | X存在质量数为24,中子数为12的核素 |
| Y | Y的单质是常用的半导体材料 |
| Z | Z的单质是一种不溶于水的淡黄色固体,易溶于CS2 |
| W | 价电子排布式3d104s1 |
(2)Y原子的最外层电子排布式是
(3)与X同周期相邻元素的第一电离能由大到小的顺序是
(4)X、Y的最高价氧化物中熔点较高的是
(5)根据W的价电子排布式,推出W的氧化物有2种,其化学式分别是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X存在质量数为24,中子数为12的核素,则其质子数为12,为Mg元素;
Y的单质是常用的半导体材料,则Y为Si元素;
Z的单质是一种不溶于水的淡黄色固体,易溶于CS2,则Z为S元素;
W的价电子排布式3d104s1,则W为Cu元素;据此解答.
Y的单质是常用的半导体材料,则Y为Si元素;
Z的单质是一种不溶于水的淡黄色固体,易溶于CS2,则Z为S元素;
W的价电子排布式3d104s1,则W为Cu元素;据此解答.
解答:
解:X存在质量数为24,中子数为12的核素,则其质子数为12,为Mg元素;Y的单质是常用的半导体材料,则Y为Si元素;Z的单质是一种不溶于水的淡黄色固体,易溶于CS2,则Z为S元素;W的价电子排布式3d104s1,则W为Cu元素;
(1)X、Y、Z、W中属于主族元素,且原子半径最小的元素是S元素,S在周期表中的位置是第三周期、第VIA族;
故答案为:第三周期、第VIA族;
(2)Y为Si元素,其原子的最外层电子排布式是3s23p2;二氧化硅与氢氧化钠反应生成硅酸钠和水,其反应的化学方程式为:SiO2+2NaOH═Na2SiO3+H2O;
故答案为:3s23p2;SiO2+2NaOH═Na2SiO3+H2O;
(3)同周期从左到右第一电离能递增,但是第IIA与第IIIA族反常,第VA与第VIA族反常,X为Mg元素,则与Mg同周期相邻元素的第一电离能由大到小的顺序是Mg>Al>Na;
故答案为:Mg>Al>Na;
(4)一般原子晶体的熔点大于离子晶体的熔点,X、Y的最高价氧化物分别为MgO、SiO2,SiO2属于原子晶体,MgO属于离子晶体,则SiO2的熔点较高;
故答案为:SiO2;
(5)Cu的化合价有+1、+2价,其氧化物为Cu2O、CuO,Cu2O与氢离子反应生成铜离子和Cu,其反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O;
故答案为:Cu2O、CuO;Cu2O+2H+=Cu2++Cu+H2O.
(1)X、Y、Z、W中属于主族元素,且原子半径最小的元素是S元素,S在周期表中的位置是第三周期、第VIA族;
故答案为:第三周期、第VIA族;
(2)Y为Si元素,其原子的最外层电子排布式是3s23p2;二氧化硅与氢氧化钠反应生成硅酸钠和水,其反应的化学方程式为:SiO2+2NaOH═Na2SiO3+H2O;
故答案为:3s23p2;SiO2+2NaOH═Na2SiO3+H2O;
(3)同周期从左到右第一电离能递增,但是第IIA与第IIIA族反常,第VA与第VIA族反常,X为Mg元素,则与Mg同周期相邻元素的第一电离能由大到小的顺序是Mg>Al>Na;
故答案为:Mg>Al>Na;
(4)一般原子晶体的熔点大于离子晶体的熔点,X、Y的最高价氧化物分别为MgO、SiO2,SiO2属于原子晶体,MgO属于离子晶体,则SiO2的熔点较高;
故答案为:SiO2;
(5)Cu的化合价有+1、+2价,其氧化物为Cu2O、CuO,Cu2O与氢离子反应生成铜离子和Cu,其反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O;
故答案为:Cu2O、CuO;Cu2O+2H+=Cu2++Cu+H2O.
点评:本题考查了元素的推断和元素的性质,侧重于考查元素在周期表中的位置、电子排布式、第一电离能、晶体熔点的比较方程式的书写等知识点,正确推断元素是解本题的关键,注意把握同周期第一电离能的变化规律,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对未知的无机盐溶液里所含的离子作鉴定,根据下列实验事实作出的判断不一定正确的是( )
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
下列离子方程式表达正确的是( )
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20H-+5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?cC(g),符合如图所示的关系(c%表示混合气中产物C的百分含量,T表示温度,P表示压强,t表示时间).在图中,Y轴是指( )
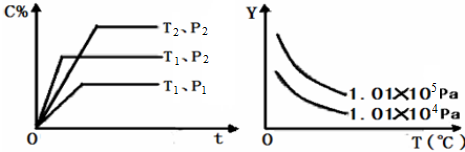

| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则( )
| A、分子中C、H、O个数之比为1:2:3 |
| B、分子中C、H个数之比为1:4 |
| C、分子中不可能含有氧原子 |
| D、此有机物的最简式为CH4 |
 .
. 所示,
所示,