题目内容
10.下列递变规律不正确的是( )| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子半径依次增大 | D. | P、S、Cl最高正价依次升高 |
分析 A.同周期从左向右金属性减弱,还原性减弱;
B.同主族从上到下非金属性减弱;
C.同周期从左向右原子半径减小;
D.第三周期元素的最高正价从左向右增大.
解答 解:A.同周期从左向右金属性减弱,还原性减弱,则Na、Mg、Al还原性依次减弱,故A正确;
B.同主族从上到下非金属性减弱,对应单质的氧化性减弱,则I2、Br2、Cl2氧化性依次增强,故B正确;
C.同周期从左向右原子半径减小,则C、N、O原子半径依次减小,故C错误;
D.第三周期元素的最高正价从左向右增大,则P、S、Cl最高正价依次升高,故D正确;
故选C.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
9.请你观察下列几个装置示意图,有关叙述正确的是( )
| A. |  装置中阳极上析出红色固体 | B. | 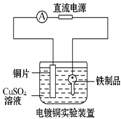 装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
10.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅤⅡA族的为最大 | |
| B. | 同主族元素两种元素原子的核外电子数的差值可能为26 | |
| C. | 短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| D. | 同周期第ⅡA族和ⅢA族元素的原子序数之差不可能为25 |
15.下列说法正确的是( )
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
2.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3NA |
19.某元素的一种核素R失去电子后形成阳离子 Rn+,其核外共有x个电子,已知该核素的质量数为A,则其中子数为( )
| A. | A-x-n | B. | A-x+n | C. | A+x-n | D. | A+x+n |
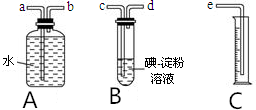 某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.
某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.