题目内容
7.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g) 达平衡的标志是( )| A. | v正(N2)=v逆(N2) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=3 v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故A正确;
B、都体现正反应方向,未体现正与逆的关系,故B错误;
C、v正(H2)=3 v逆(NH3),速率之比不等于计量数之比,故C错误;
D、当体系达平衡状态时,N2、H2、NH3的体积比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
6.下列属于放热反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
15.下列说法正确的是( )
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
2.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3NA |
12.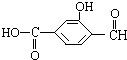 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
19.某元素的一种核素R失去电子后形成阳离子 Rn+,其核外共有x个电子,已知该核素的质量数为A,则其中子数为( )
| A. | A-x-n | B. | A-x+n | C. | A+x-n | D. | A+x+n |
16.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol醇和2mol乙酸,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O3 | D. | C14H10O3 |
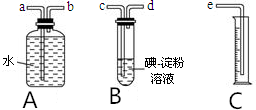 某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.
某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.
 .
. .
. 能与NaOH溶液和Na2CO3溶液反应,而使冬青油变质.
能与NaOH溶液和Na2CO3溶液反应,而使冬青油变质.