题目内容
11.在给定的条件下,下列选项所示的物质间转化均能实现的是( )| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}、高温}{→}$SiCl4$\stackrel{H_{2}、高温}{→}$Si | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2 $\stackrel{电解}{→}$Mg |
分析 A、硫与氧气反应生成二氧化硫;
B.氨气催化氧化生成氮气,氮气不能和氧气在水溶液中形成硝酸;
C.二氧化硅和碳反应生成硅,硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成高纯硅;
D.海水中加入熟石灰生成氢氧化镁沉淀,氢氧化镁和盐酸反应生成氯化镁,电解氯化镁固体得到金属镁.
解答 解:A、硫与氧气反应生成二氧化硫,而不是三氧化硫,故A错误;
B.转化关系中氮气、氧气和水不能直接生成硝酸,故B错误;
C.二氧化硅制备高纯度硅,利用碳还原二氧化硅生成粗硅,粗硅和氯气反应生成四氯化硅,四氯化硅被氢气还原生成高纯度硅,故C正确;
D.制备金属镁不是电解氢氧化镁,氢氧化镁熔融分解生成的氧化镁熔点高,工业上电解熔融氯化镁生成金属镁,故D错误;
故选C.
点评 本题考查了物质性质、物质转化的应用,主要是硫、硅、氮的化合物性质的理解判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
2. 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
19. 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且半分钟不恢复原色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D、E(填序号).
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若第一次滴定开始和结束时,酸式滴定管中的液面如图所示.则起始读数为V1=9.00mL,终点读数V2=26.10mL.
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710mol•L-1.
 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且半分钟不恢复原色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D、E(填序号).
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若第一次滴定开始和结束时,酸式滴定管中的液面如图所示.则起始读数为V1=9.00mL,终点读数V2=26.10mL.
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710mol•L-1.
| 滴定 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | V1 | V2 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
6.某同学在实验报告中记录下列数据,其中不正确的是( )
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
18.实验室里需要480mL 0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取12.5g胆矾配成500mL溶液 | B. | 称取8.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取7.68g硫酸铜,加入500mL水 |
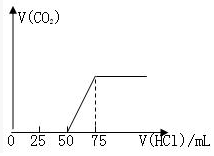 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?