题目内容
19.可逆反应N2(g)+3H2(g)?2NH3(g),在容积为10L的密闭容器中进行,开始时加入2mol N2和3mol H2,则达到平衡时,NH3的浓度不可能达到( )| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.05 mol/L | D. | 0.15 mol/L |
分析 依据反应是可逆反应,不能进行彻底分析计算判断,可以利用极值法分析,以此解答该题.
解答 解:该反应为可逆反应,则在容积为10L的密闭容器中进行,开始时加入2mol N2和3mol H2,则达到平衡时,n(NH3)<2mol,c(NH3)<0.2mol/L,
故选B.
点评 本题考查了可逆反应的特征应用,为高频考点,侧重于学生的分析能力的考查,注意反应不能进行彻底的特点,题目难度中等.

练习册系列答案
相关题目
11.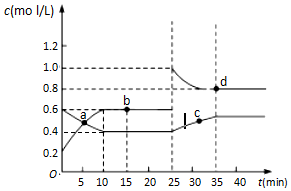 已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
 已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )| A. | 前l0min内,用v(NO2)表示的该反应速率为0.02mol/(L•min) | |
| B. | 反应进行到l0 min时,体系吸收的热量为9.76 kJ | |
| C. | b点的速率大于c点的速率 | |
| D. | 25min时,导致平衡移动原因是增大压强 |
7.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),下列说法中不正确的是( )
| A. | NO的消耗速率等于CO2的生成速率时,反应不一定达到平衡 | |
| B. | CO的消耗速率是N2消耗速率的两倍时达到平衡 | |
| C. | 反应达到平衡后,NO的浓度等于CO2的浓度 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
14.下列溶液中,Cl-的物质的量浓度最大的是( )
| A. | 100mL 0.5mol•L-1AlCl3(aq) | B. | 200mL 0.5mol•L-1MgCl2(aq) | ||
| C. | 300mL 1mol•L-1NaCl(aq) | D. | 400mL 0.5mol•L-1BaCl2(aq) |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,64g SO2气体中所含分子数为NA | |
| B. | 标准状况下,4.48L四氯化碳中所含原子总数为NA | |
| C. | 1mol HNO3作氧化剂时转移电子数为3NA | |
| D. | 常温常压下,11.2L NO2中所含分子数为0.5NA |
9.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、K+、Br-、Cl- | B. | Na+、Cu2+、OH-、SO42- | ||
| C. | Mg2+、H+、CH3COO-、SO42- | D. | HCO3-、NO3-、OH-、Na+ |