题目内容
书写下列粒子的电子式
NaOH -OH H2O2 NH4Cl .
NaOH
考点:电子式
专题:化学键与晶体结构
分析:氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
羟基中含有1个氢氧键,氧原子最外层为7个电子;
双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起.
羟基中含有1个氢氧键,氧原子最外层为7个电子;
双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起.
解答:
解:氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ;
;
羟基中的氧原子含有7个电子,含有1个氢氧键,羟基的电子式为: ;
;
双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
故答案为: ;
; ;
; ;
; .
.
 ;
;羟基中的氧原子含有7个电子,含有1个氢氧键,羟基的电子式为:
 ;
;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
 ;
;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
 ;
;故答案为:
 ;
; ;
; ;
; .
.
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
下列各组物质中,属于醇类但不是同系物的是( )
| A、CH3OH和CH3CH2CH2OH |
| B、CH3COOH和C6H5CH2OH |
| C、CH3CH2OH和CH2=CHCH2OH |
| D、C6H5OH和C6H5CH2OH |
下列说法正确的是( )
| A、SO2、SO3都是极性分子 |
| B、凡是中心原子采取sp3杂化轨道成键的分子其空间构型都是正四面体 |
| C、同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 |
| D、干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
下列说法正确的是( )
| A、气体摩尔体积就是22.4L/mol |
| B、非标准状况下,1mol任何气体的体积不可能为22.4L |
| C、标准状况下22.4L任何物质都含有约6.02×1023个分子 |
| D、1molH2和O2的混合气体在标准状况下的体积约22.4L |
分类在科学研究中必须用的方法,下列关于化学的分类说法正确的是( )
| A、干冰、HD均为化合物;水玻璃、水银均为混合物;纯碱和生石灰分别属于碱和氧化物;蔗糖、PVC、淀粉都是高分子化合物 |
| B、根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等 |
| C、由于饱和碳酸钙的导电性比饱和氨水的导电性弱,所以碳酸钙是弱电解质 |
| D、根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 |
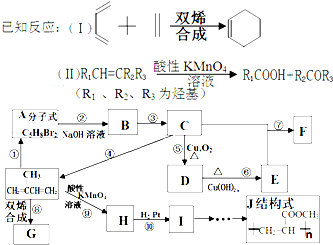
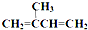 )为主要原料来进行的有机合成:
)为主要原料来进行的有机合成: