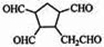
题目内容
8.下列各组物质分类正确的是( )| 酸 | 碱 | 盐 | 氧化物 | |
| A | H2SO4 | Na2CO3 | NaCl | CO2 |
| B | HCl | NaOH | NaHCO3 | CaO |
| C | CO2 | NH3•H2O | Na2CO3 | CuO |
| D | CH3COOH | KOH | KCl | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物属于盐,氧化物是含有两种元素且其中一种元素是氧元素的化合物,据此分析.
解答 解:A、硫酸电离时生成的阳离子都是氢离子,都属于酸,Na2CO3 是钠离子和碳酸根离子构成的盐,不是碱,NaCl属于盐,CO2属于氧化物,故A错误;
B、HCl水溶液中电离出的阳离子全部是氢离子的化合物为酸,NaOH水溶液中电离出的阴离子全部是氢氧根离子的化合物属于碱,NaHCO3是钠离子和碳酸氢根离子构成属于盐,CaO是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,故B正确;
C、CO2是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,NH3•H2O水溶液中电离出的阴离子全部是氢氧根离子的化合物属于碱,Na2CO3 是钠离子和碳酸根离子构成的盐,CuO属于氧化物,故C错误;
D、CH3COOH水溶液中电离出的阳离子全部是氢离子的化合物为酸,KOH水溶液中电离出的阴离子全部是氢氧根离子的化合物属于碱,KCl是钾离子和氯离子构成的盐,KClO3是钾离子和氯酸根离子构成的盐,不是氧化物,故D错误.
故选B,
点评 本题主要考查盐的概念,解答时要分析各种物质的组成,然后再根据酸、碱、盐、氧化物概念的含义进行分析、判断,从而得出正确的结论,题目较简单.

练习册系列答案
相关题目
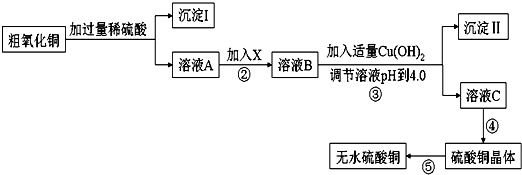
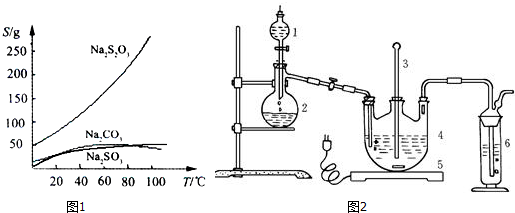
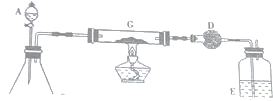
3.某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜.
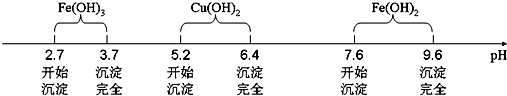
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
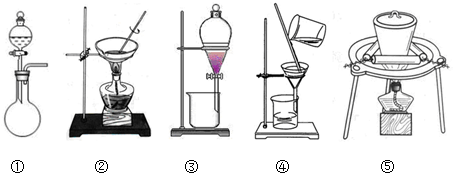
(1)在整个实验过程中,下列实验装置不可能用到的是①③(填序号)
(2)溶液A中所含溶质为CuSO4、FeSO4、H2SO4;
(3)物质X应选用②(填序号),沉淀Ⅱ的主要成分是Fe(OH)3
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为蒸发浓缩、冷却结晶、过滤、自然干燥.
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度.过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL.
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质.
第三步:以淀粉溶液为指示剂,用0.05000mol•L-1的Na2S2O3标准溶液滴定,前后共测定三组.达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-═2I-+S4O62-)
①CuSO4溶液与KI的反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②滴定中,试液Na2S2O3应放在碱式滴定管(填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是最后一滴试液滴入,溶液由蓝色变为无色,振荡半分钟,溶液无明显变化.
③溶液A中c(Cu2+)=0.5000mol•L-1.

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是①③(填序号)

(2)溶液A中所含溶质为CuSO4、FeSO4、H2SO4;
(3)物质X应选用②(填序号),沉淀Ⅱ的主要成分是Fe(OH)3
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为蒸发浓缩、冷却结晶、过滤、自然干燥.
(5)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度.过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL.
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质.
第三步:以淀粉溶液为指示剂,用0.05000mol•L-1的Na2S2O3标准溶液滴定,前后共测定三组.达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-═2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
②滴定中,试液Na2S2O3应放在碱式滴定管(填“酸式滴定管”或“碱式滴定管”),判断滴定终点的依据是最后一滴试液滴入,溶液由蓝色变为无色,振荡半分钟,溶液无明显变化.
③溶液A中c(Cu2+)=0.5000mol•L-1.
13.下列实验操作中正确的是( )
| A. | 分液操作时,先将分液漏斗中的下层液体放出,再将上层液体接着放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层滤纸上 |
20.下列物质属于酸的是( )
| A. | NaCl | B. | CO2 | C. | H2SO4 | D. | H2O |

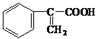 )和甲醇反应制得.
)和甲醇反应制得.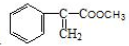
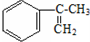 经过四步不同类型的反应制得阿托酸.
经过四步不同类型的反应制得阿托酸.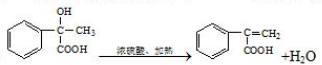 .
.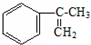 多两个碳原子的一种同系物,且A的所有碳原子可以处于同一平面上.写出A的结构简式
多两个碳原子的一种同系物,且A的所有碳原子可以处于同一平面上.写出A的结构简式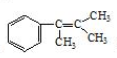 .
.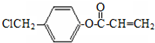 是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为
是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为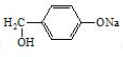 、
、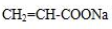 .
.