题目内容
20.下列物质属于酸的是( )| A. | NaCl | B. | CO2 | C. | H2SO4 | D. | H2O |
分析 电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物属于盐,氧化物是含有两种元素且其中一种元素是氧元素的化合物,据此分析.
解答 解:A.NaCl是钠离子和氯离子构成的盐,故A错误;
B.CO2是含有两种元素且其中一种元素是氧元素的化合物属于氧化物,故B错误;
C.H2SO4电离时生成的阳离子都是氢离子的化合物,属于酸,故C正确;
D.H2O是含有两种元素且其中一种元素是氧元素的化合物属于氧化物,故D错误;
故选C.
点评 本题主要考查酸的概念,解答时要分析各种物质的组成,然后再根据酸、碱、盐、氧化物概念的含义进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
11.已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2 (g)?2NH3 (g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
②N2(g)+3H2 (g)?2NH3 (g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 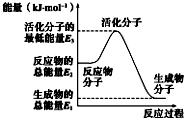 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | N2的燃烧热为180kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和 3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和 6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
8.下列各组物质分类正确的是( )
| 酸 | 碱 | 盐 | 氧化物 | |
| A | H2SO4 | Na2CO3 | NaCl | CO2 |
| B | HCl | NaOH | NaHCO3 | CaO |
| C | CO2 | NH3•H2O | Na2CO3 | CuO |
| D | CH3COOH | KOH | KCl | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
9.下列有机物命名正确的是( )
| A. |  乙基苯 乙基苯 | B. |  1-甲基乙醇 1-甲基乙醇 | ||
| C. | 2-甲基-1-丁炔 | D. | 2,3,3-三甲基丁烷 |
10. 常温下有浓度为0.1mol/L,体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应.根据图象回答下列问题:
常温下有浓度为0.1mol/L,体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应.根据图象回答下列问题:
(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
(2)该温度时氨水的电离平衡常数K数值约为10-5.滴定过程中所用盐酸的pH=1.
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为0.01 moI/L.
 常温下有浓度为0.1mol/L,体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应.根据图象回答下列问题:
常温下有浓度为0.1mol/L,体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应.根据图象回答下列问题:(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
| 离子浓度大小顺序 | 溶质化学式 | 溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) | ① | >7 |
| ② | ③ | =7 |
| ④ | NH4Cl | ⑤ |
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为0.01 moI/L.