题目内容
10.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S $\frac{\underline{\;\;△\;\;}}{\;}$ Na2S2O3,常温下溶液中析出晶体为Na2S2O3•5H2O.Na2S2O3•5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇.在水中有关物质的溶解度曲线如图1所示.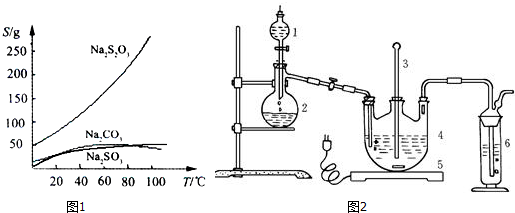
Ⅰ.现按如下方法制备Na2S2O3•5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按图2安装好装置.
(1)仪器2的名称为蒸馏烧瓶,装置6中可放入CD.
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2
②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O
④Na2SO3+S$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时.当溶液中pH接近或不小于7时,即可停止通气和加热.溶液PH要控制不小于7理由是S2O32-+2H+=S↓+SO2↑+H2O(用离子方程式表示).
Ⅱ.分离Na2S2O3•5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为趁热过滤,操作②是抽滤洗涤干燥,其中洗涤操作是用乙醇(填试剂)作洗涤剂.
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高温度过高会导致析出的晶体分解
(3)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克.平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+═3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-═2I-+S4O62-,滴定终点的现象为溶液由蓝色恰好变成无色,且半分钟不恢复.三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为0.2000 mol/L.
分析 Ⅰ.(1)根据仪器的构造来确定仪器2的名称;实验中有SO2生成,而SO2是大气污染物,不能随意排放,需要尾气处理,酸性高锰酸钾溶液或氢氧化钠溶液可以和二氧化硫之间反应;
(2)在酸性条件下,硫代硫酸钠易生成SO2、S和水;
Ⅱ.(1)硫代硫酸钠的溶解度随温度的升高而降低,据此确定物质的分离方法;Na2S2O3易溶于水,不溶于乙醇,所以洗涤时要注意硫代硫酸钠的损耗;
(2)根据Na2S2O3•5H2O于40~45℃熔化,48℃分解的性质来回答;
(3)碘遇淀粉显蓝色,根据发生的反应,得到关系式:K2Cr2O7~3I2~6 Na2S2O3,据此计算即可.
解答 解:Ⅰ.(1)根据仪器的构造可知,仪器2的名称为蒸馏烧瓶;由于实验中有SO2生成,而SO2是大气污染物,不能随意排放,需要尾气处理.随意装置6的作用是吸收SO2,防止污染空气.SO2是酸性氧化物,且具有还原性,所以可用酸性高锰酸钾溶液或氢氧化钠溶液吸收,选CD,
故答案为:蒸馏烧瓶;CD;
(2)因为在酸性条件下,硫代硫酸钠易生成SO2、S和水,反应的离子方程式是S2O32-+2H+=S↓+SO2↑+H2O,所以溶液pH要控制不小于7.
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
Ⅱ.(1)由于硫代硫酸钠的溶解度随温度的升高而降低,所以操作I应该是趁热过滤;Na2S2O3易溶于水,不溶于乙醇,所以为防止洗涤损失硫代硫酸钠,应该用乙醇作洗涤剂.
故答案为:趁热过滤;乙醇;
(2)由于Na2S2O3•5H2O于40~45℃熔化,48℃分解,所以蒸发时要控制温度不宜过高的原因是温度过高会导致析出的晶体分解.
故答案为:温度过高会导致析出的晶体分解;
(3)由于碘遇淀粉显蓝色,所以滴定终点的现象为溶液由蓝色恰好变成无色,且半分钟不恢复;根据反应的方程式可知:
K2Cr2O7~3I2~6 Na2S2O3
1mol 6mol
$\frac{1}{3}$×$\frac{0.5880}{294}$mol c×0.02000L
解得c=0.2000mol/L,
故答案为:溶液由蓝色恰好变成无色,且半分钟不恢复;0.2000.
点评 本题以实验探究的方式考查物质的分离和提纯方面的知识,属于综合知识的考查,注意知识的归纳和梳理是解题的关键,难度较大.

| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| C. | 对于有气体参加的反应,增大压强,反应速率加快 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
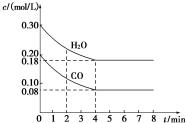 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | C4 |
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.
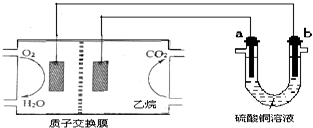
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | a极是铜,b极是铁时,硫酸铜溶液浓度减小 | |
| C. | a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的7/2 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
| A. | Na2CO3溶液和Ca(OH)2溶液 | B. | Na2O和H2O | ||
| C. | Na2SO4溶液和CuCl2溶液 | D. | Na和NaCl溶液 |
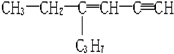 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )| A. | 5,6,4 | B. | 5,3,6 | C. | 5,4,8 | D. | 5,3,5 |
| 酸 | 碱 | 盐 | 氧化物 | |
| A | H2SO4 | Na2CO3 | NaCl | CO2 |
| B | HCl | NaOH | NaHCO3 | CaO |
| C | CO2 | NH3•H2O | Na2CO3 | CuO |
| D | CH3COOH | KOH | KCl | KClO3 |
| A. | A | B. | B | C. | C | D. | D |