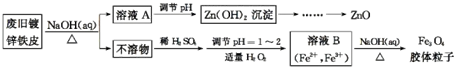
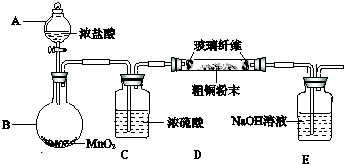
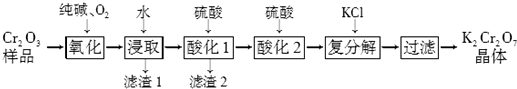
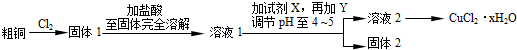题目内容
12.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: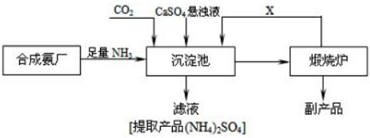
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是蒸馏液态空气或者液化;
(2)工业合成氨反应的化学方程式是N2+3H2$?_{催化剂}^{高温、高压}$2NH3
(3)沉淀池中发生反应的主要方程式是CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
(4)上述生产流程中,有关NH3的作用及说明正确的是AB
A.提供制各产品所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是CO2.从绿色化学和资源综合利用的角度说明上述流程的主要优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成.
(6)写出硫酸钙的其它一种用途生产水泥或石膏.
分析 工业合成氨的反应原理为N2+3H2 $?_{催化剂}^{高温、高压}$2NH3,将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;
(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得;
(2)根据反应物、生成物及反应条件书写方程式;
(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵;
(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵;
B.增大反应物浓度平衡正向移动;
C.氨气是反应物;
(5)在流程图中能作反应物和生成物的能循环利用;反应物能完全转化为生成物符合绿色化学理念且能充分利用资源;
(6)硫酸钙能用于生产水泥或石膏.
解答 解:工业合成氨的反应原理为N2+3H2 $?_{催化剂}^{高温、高压}$2NH3,将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;
(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得,故答案为:蒸馏液态空气或者液化;
(2)在高温、高压、催化剂条件下氮气和氢气发生化合反应生成氨气,反应方程式为N2+3H2 $?_{催化剂}^{高温、高压}$2NH3,
故答案为:N2+3H2 $?_{催化剂}^{高温、高压}$2NH3;
(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;
(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵,所以氨气提供制各产品所需的氮元素
,故A正确;
B.增大反应物浓度平衡正向移动,所以增大CO32-的浓度促进反应发生
,故B正确;
C.氨气是反应物,而不是催化剂,故C错误;
故选AB;
(5)在流程图中能作反应物和生成物的能循环利用,可以循环利用的物质有CO2,反应物能完全转化为生成物符合绿色化学理念且能充分利用资源,所以优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,故答案为:CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成;
(6)硫酸钙能用于生产水泥或石膏,故答案为:生产水泥或石膏.
点评 本题考查物质的制备实验方案的设计,题目难度中等,本题注意把握物质的性质,注意根据反应物和生成物从质量守恒的角度书写反应的化学方程式.

 名校课堂系列答案
名校课堂系列答案| A. | S的燃烧热为△H=-297.23kJ/mol | |
| B. | S(s)→S(g) 吸收热量 | |
| C. | S(g)+O2 (g)═SO2 (g) 放出的热量小于297.23kJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
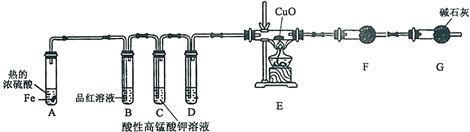
 实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)
实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)