题目内容
20.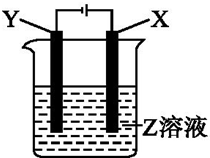 根据如图所示装置回答:
根据如图所示装置回答:(1)当X为Pt,Y为Fe,Z为AgNO3时,
阳极反应为4OH--4e-=O2↑+2H2O,
阴极反应为4Ag++4e-=4Ag
(2)X为Cu,Y为Fe,Z为CuSO4时,
阳极反应为Cu-2e-=Cu2+,
阴极反应为Cu2++2e-=Cu.
(3)用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为1mol/L.
分析 (1)当X为Pt,Y为Fe,Z为AgNO3时,X极上氢氧根离子放电、Y电极上银离子放电,根据阴阳极上放电的离子书写电池反应式;
(2)X为Cu,Y为Fe,Z为CuSO4时,X电极上Cu失电子发生氧化反应、Y电极上铜离子放电,据此书写电极反应式;
(3)用Pt电极电解1L含CuSO4和KNO3混合溶液,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,依据两极生成气体物质的量结合电解过程中电子守恒计算便可求解.
解答 解:(1)当X为Pt,Y为Fe,Z为AgNO3时,X极上氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,阴极上银离子放电,电极反应为4Ag++4e-=4Ag,所以电池反应式为2H2O+4Ag+$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,故答案为:4OH--4e-=O2↑+2H2O;4Ag++4e-=4Ag;
(2)X为Cu,Y为Fe,Z为CuSO4时,X电极上Cu失电子发生氧化反应、Y电极上铜离子放电,阳极电极反应为Cu-2e-=Cu2+,阴极反应为:Cu2++2e-=Cu,故答案为:Cu-2e-=Cu2+;Cu2++2e-=Cu;
(3)用Pt电极电解1L含CuSO4和KNO3混合溶液,在两极均生成标准状况下的气体11.2L,气体的物质的量为n=$\frac{11.2L}{22.4L/mol}$=0.5mol,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,生成0.5molO2,需电子为4×0.5mol=2mol;
阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,生成0.5molH2,需0.5mol×2=1mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.5mol,所以Cu2+的物质的量浓度c=$\frac{0.5mol}{0.5L}$=1mol/L,
故答案为:1.
点评 本题考查了电极原理的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意电子守恒的计算应用和正确书写电极反应,明确电极的放电顺序为解答该题的关键,题目难度中等.

| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 达到平衡后,充入氦气,反应速率增大 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,增大A2(g)的浓度,B2的转化率增大 |
由H、O、C、Fe组成的常见化合物中,属于酸性氧化物的是CO2,属于无机含氧酸的是H2CO3,属于碱的是Fe(OH)2或Fe(OH)3,属于有机物的是C2H5OH,CH4.
| A. | Cl-、HCO3-、Na+、K+ | B. | NO3-、Ba2+、K+、Cl- | ||
| C. | Fe3+、NO3-、K+、H+ | D. | Al3+、SO42-、NH4+、Cl- |
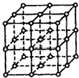 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.

 .
. .
. .
. .
.