题目内容
2.下列关于铜电极的叙述正确的是( )| A. | 用电解法精炼铜时,粗铜作阴极、精铜作阳极 | |
| B. | 在镀件上电镀铜时,用金属铜作阳极 | |
| C. | 在电解池中,铜作电极时,溶液中的阴离子在铜极上失电子 | |
| D. | 电解饱和食盐水制稀硫酸制Cl2、H2时,可用金属铜作阳极 |
分析 A.粗铜精炼时粗铜作阳极;
B.电镀Cu时Cu作阳极,在镀件阴极上铜离子得到电子生成Cu;
C.在电解池中,铜作电极时,在阳极上是金属铜失电子的氧化反应;
D.电解食盐水用惰性电极作阳极,则电极本身失电子,发生氧化反应.
解答 解:A.粗铜精炼时粗铜作阳极,纯铜作阴极,故A错误;
B.电镀Cu时Cu作阳极,在镀件上铜离子得到电子生成Cu,故B正确;
C、在电解池中,铜作电极时,在阴极上是电解质里的阳离子得电子,在阳极上是金属铜失电子的氧化反应,电解质的阴离子不会放电,故C错误;
D.电解食盐水用惰性电极作阳极,若利用Cu为阳极,则生成氢氧化铜沉淀,故D错误;
故选B.
点评 本题考查原电池和电解原理的应用,明确粗铜精炼、电镀、电解食盐水等电解的应用是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
10.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 1mol•L-1 K2SO4溶液中含有的SO42-离子数目为NA | |
| B. | 标准状况下,22.4LH2O含有的分子数目为NA | |
| C. | 常温常压下,22gCO2中含有的氧原子数目为NA | |
| D. | 1molMg变为Mg2+时失去的电子数目为NA |
17.向CuSO4和Fe2(SO4)3的混合溶液中加入一定质量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无明显现象,下列叙述中正确的是( )
| A. | 滤液中一定有Cu2+ | B. | 滤液中一定无Cu2+ | ||
| C. | 滤液中一定有Fe3+ | D. | 滤液中一定无Fe3+ |
7. 已知某反应过程在不同条件下的能量变化情况如图所示(改变的条件仅为催化剂),下列判断错误的是( )
已知某反应过程在不同条件下的能量变化情况如图所示(改变的条件仅为催化剂),下列判断错误的是( )
 已知某反应过程在不同条件下的能量变化情况如图所示(改变的条件仅为催化剂),下列判断错误的是( )
已知某反应过程在不同条件下的能量变化情况如图所示(改变的条件仅为催化剂),下列判断错误的是( )| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 曲线Ⅰ和曲线Ⅱ相比较,曲线Ⅱ使用了催化剂 | |
| C. | 该反应可以表示为:CO(g)+2H2(g)?CH3OH(g)△=0.91KJ•mol-1 | |
| D. | 如果该反应生成液态CH3OH,则△H增大 |
14.修正液(俗称涂改液)白色纯正、反射率高且使用方便,复印时常用于对文稿的修改.目前有许多中小学生使用修正液,用于修改笔记、作业等.由于修正液中含有挥发性的有毒溶剂,教师应告诫学生不要使用.修正液中所含的有毒成分可能是( )
| A. | 乙醇 | B. | 醋酸 | C. | 一氯甲烷 | D. | 三氯乙烯 |
12.将物质的量共为a mol的NaNO3、Cu(NO3)2和AgNO3的固体混合物用酒精灯加热至恒重,收集到的气体再用足量的水吸收,剩余气体为b mol,则b可能为( )
| A. | 0 | B. | 0.25a | C. | 0.45a | D. | 0.50a |
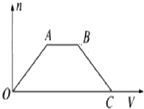 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )