题目内容
10.下列有关性质的比较,不能用元素周期律解释的是( )| A. | 酸性:H2CO3>H2SiO3 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:K2CO3>KHCO3 |
分析 A.非金属性越强,最高价含氧酸的酸性越强;
B.O、S位于同主族,从上到下非金属性减弱;
C.金属性越强,最高价含氧酸的碱性越强;
D.KHCO3加热分解生成碳酸钾.
解答 解:A.C、Si位于同主族,非金属性C>Si,最高价含氧酸的酸性为H2CO3>H2SiO3,能用元素周期律解释,故A正确;
B.O、S位于同主族,从上到下非金属性减弱,非金属性:O>S,能用元素周期律解释,故B正确;
C.Na、Al位于同周期,金属性Na>Al,最高价含氧酸的碱性为NaOH>Al(OH)3,能用元素周期律解释,故C正确;
D.KHCO3加热分解生成碳酸钾,热稳定性:K2CO3>KHCO3,但不能用元素周期律解释,故D错误;
故选D.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列说法中正确的是( )
| A. | 常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 | |
| B. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | |
| C. | 含1mol硫酸的稀溶液与含1molBa(OH)2的稀溶液完全中和所放出的热量为中和热 | |
| D. | 在25℃、101KPa时,2mol 氢气的燃烧热是1mol 氢气的2倍 |
18.下列有关电化学原理的说法中,不正确的是( )
| A. | 镀锌铁制品镀层受损后,铁制品也不容易生锈 | |
| B. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 将钢闸门与直流电源的负极相连,可降低钢闸门腐蚀速率 |
5.已知E1=134kJ•mol-1、E2=368kJ•mol-1,请参考题中图表,根据要求回答问题:
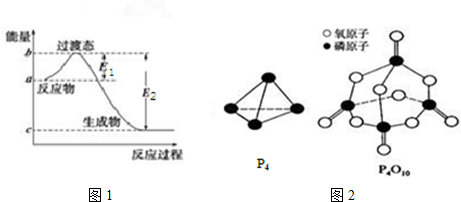
(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为dkJ•mol-1,白磷及其完全燃烧的产物的结构如图2所示,则表中x=$\frac{6a+5c+d-12b}{4}$kJ•mol-1(用含a、b、c、d的代表数式表示).

(1)图1是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
15.X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法正确的是( )
| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | XW2熔沸点较低,可能是共价化合物 | |
| D. | 工业制Y可以电解熔融的YW3制得 |
2.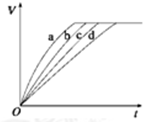 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
19.下列物质中,既含有离子键又含有共价键的是( )
| A. | K2O | B. | CH3COOH | C. | NH4NO3 | D. | H2SO4 |
20.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |