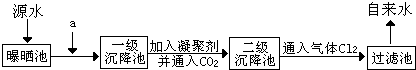
题目内容
某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损.由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究.部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸,化学式:H2SO4 相对分子质量:98,质量分数:98% 密度:1.98g/cm3.
甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8mol?L-1,则该溶液的质量分数为98%.
乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定.具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量.
丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积.
请回答下列问题:(1)乙同学推测甲同学的方案不可行的理由是
(2)乙同学的方案的关键操作有两点:①确保SO
完全沉淀;②洗涤沉淀,确保沉淀不含杂质.在实际中,洗涤沉淀的操作方法是 ;,
设计简单实验检验SO
是否完全沉淀:
(3)在丙同学的方案中步骤②用到的指示剂是 ;达到滴定终点的标志是 .
(4)丙同学的方案中,下列操作对测定结果的影响无法确定的是 .
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:,
通过计算,确认该浓硫酸质量分数与标签是否相符? (填“相符”或“不相符”),理由(计算步骤)是 .
甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8mol?L-1,则该溶液的质量分数为98%.
乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定.具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量.
丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积.
请回答下列问题:(1)乙同学推测甲同学的方案不可行的理由是
(2)乙同学的方案的关键操作有两点:①确保SO
2- 4 |
设计简单实验检验SO
2- 4 |
(3)在丙同学的方案中步骤②用到的指示剂是
(4)丙同学的方案中,下列操作对测定结果的影响无法确定的是
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:,
| 实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
| ① | 5.00mL | 35.65mL | 5.00mol?L-1 |
| ② | 5.00mL | 39.65mL | 5.00mol?L-1 |
| ③ | 5.00mL | 35.55mL | 5.00mol?L-1 |
考点:性质实验方案的设计,化学实验方案的评价
专题:实验设计题
分析:(1)浓硫酸含水少,硫酸基本不电离,主要以分子形式存在;
(2)洗涤沉淀的操作方法是通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水自行流出后,再注入蒸馏水,重复多次直到沉淀洗净为止;检验SO42-是否完全沉淀是取上层清液,滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO42-没有完全沉淀,若不产生白色沉淀,则说明SO42-已完全沉淀;
(3)氢氧化钠滴定硫酸用酚酞试液作指示剂;达到滴定终点的标志是当滴入最后一滴,溶液由无色变成粉红色,且半分钟内不褪色;
(4)根据C(H2SO4)=
来判断;
(5)根据实验数据舍去误差大的数据(VNaOH=39.65 mL),可得V(NaOH)=
=35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)=
mol?L-1=19.8mol?L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=
mol?L-1=17.8mol?L-1<19.8mol?L-1,所以不相符.
(2)洗涤沉淀的操作方法是通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水自行流出后,再注入蒸馏水,重复多次直到沉淀洗净为止;检验SO42-是否完全沉淀是取上层清液,滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO42-没有完全沉淀,若不产生白色沉淀,则说明SO42-已完全沉淀;
(3)氢氧化钠滴定硫酸用酚酞试液作指示剂;达到滴定终点的标志是当滴入最后一滴,溶液由无色变成粉红色,且半分钟内不褪色;
(4)根据C(H2SO4)=
| C(NaOH)V(NaOH) |
| 2V(H 2SO 4) |
(5)根据实验数据舍去误差大的数据(VNaOH=39.65 mL),可得V(NaOH)=
| 35.65mL+35.55mL |
| 2 |
| 1000×1.98×98% |
| 98×1 |
| 35.60×10-3×5.00 |
| 2×5.00×10-3 |
解答:
解:(1)浓硫酸含水少,硫酸基本不电离,主要以分子形式存在,所以测不出氢离子浓度,故答案为:浓硫酸含水少,硫酸主要以分子形式存在;
(2)洗涤沉淀的操作方法是通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水自行流出后,再注入蒸馏水,重复多次直到沉淀洗净为止;检验SO42-是否完全沉淀是取上层清液,滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO42-没有完全沉淀,若不产生白色沉淀,则说明SO42-已完全沉淀;
故答案为:通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水流出后,再注入蒸馏水,重复多次直到沉淀洗净为止;在上层清液中滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO42-没有完全沉淀,若不产生白色沉淀,则说明SO42-已完全沉淀;
(3)氢氧化钠滴定硫酸用酚酞试液作指示剂;达到滴定终点的标志是当滴入最后一滴,溶液由无色变成粉红色,且半分钟内不褪色;
故答案为:酚酞试液;当滴入最后一滴,溶液由无色变成粉红色,且半分钟内不褪色;
(4)①在滴定前未用NaOH标准溶液润洗滴定管,则导致氢氧化钠的浓度被稀释,所以滴下的氢氧化钠偏大,硫酸浓度偏大;
②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,无法判断;
③锥形瓶用蒸馏水洗净后,没有用待测液润洗,对氢氧化钠的量没有影响,所以硫酸浓度不变;
④滴定前,仰视读数,滴定后,仍仰视读数,无法判断体积变化;
⑤滴定前,仰视读数,滴定后俯视读数,读数比真实值偏小,故硫酸浓度偏小;
故答案为:②④;
(5)根据实验数据舍去误差大的数据(VNaOH=39.65 mL),可得V(NaOH)=
=35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)=
mol?L-1=19.8mol?L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=
mol?L-1=17.8mol?L-1<19.8mol?L-1,所以不相符;故答案为:不相符;舍去误差大的数据(VNaOH=39.65 mL),可得V(NaOH)=
=35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)=
mol?L-1=19.8mol?L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=
mol?L-1=17.8mol?L-1<19.8mol?L-1,
(2)洗涤沉淀的操作方法是通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水自行流出后,再注入蒸馏水,重复多次直到沉淀洗净为止;检验SO42-是否完全沉淀是取上层清液,滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO42-没有完全沉淀,若不产生白色沉淀,则说明SO42-已完全沉淀;
故答案为:通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水流出后,再注入蒸馏水,重复多次直到沉淀洗净为止;在上层清液中滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO42-没有完全沉淀,若不产生白色沉淀,则说明SO42-已完全沉淀;
(3)氢氧化钠滴定硫酸用酚酞试液作指示剂;达到滴定终点的标志是当滴入最后一滴,溶液由无色变成粉红色,且半分钟内不褪色;
故答案为:酚酞试液;当滴入最后一滴,溶液由无色变成粉红色,且半分钟内不褪色;
(4)①在滴定前未用NaOH标准溶液润洗滴定管,则导致氢氧化钠的浓度被稀释,所以滴下的氢氧化钠偏大,硫酸浓度偏大;
②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,无法判断;
③锥形瓶用蒸馏水洗净后,没有用待测液润洗,对氢氧化钠的量没有影响,所以硫酸浓度不变;
④滴定前,仰视读数,滴定后,仍仰视读数,无法判断体积变化;
⑤滴定前,仰视读数,滴定后俯视读数,读数比真实值偏小,故硫酸浓度偏小;
故答案为:②④;
(5)根据实验数据舍去误差大的数据(VNaOH=39.65 mL),可得V(NaOH)=
| 35.65mL+35.55mL |
| 2 |
| 1000×1.98×98% |
| 98×1 |
| 35.60×10-3×5.00 |
| 2×5.00×10-3 |
| 35.65mL+35.55mL |
| 2 |
| 1000×1.98×98% |
| 98×1 |
| 35.60×10-3×5.00 |
| 2×5.00×10-3 |
点评:本题主要考查了硫酸浓度的测定实验,着重考查洗涤,沉淀是否完全的具体操作以及中和滴定实验的操作,计算,误差分析等,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于阿佛加德罗常数的说法正确的是( )
| A、1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
| B、一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA |
| C、常温下18g铝放入足量浓硫酸中转移电子数2NA |
| D、0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 |
如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )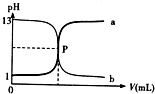

| A、P 点时反应恰好完全中和,溶液呈中性 |
| B、盐酸的物质的量浓度为1mol/L |
| C、曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D、酚酞不能用做本实验的指示剂 |
部分弱酸的电离平衡常数如下表:下列说法正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
| A、0.1mol?L-1NaHCO3溶液中浓度的大小:c(Na+)>c(HCO 3-)>c(H+)>c(OH-) |
| B、少量的CO2通入到NaCN溶液中 CN-+H2O+CO2=HCN+HCO 3- |
| C、用0.1mol?L-1NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大 |
| D、0.1mol?L-1HCOONa溶液比0.1mol?L-1NaCN溶液所含离子总数小 |
下列物质中属于纯净物、化合物、盐、钙盐的是( )
| A、石灰石 |
| B、Ca(OH)2 |
| C、CaCO3 |
| D、CaO |