题目内容
如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )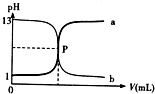

| A、P 点时反应恰好完全中和,溶液呈中性 |
| B、盐酸的物质的量浓度为1mol/L |
| C、曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D、酚酞不能用做本实验的指示剂 |
考点:中和滴定
专题:
分析:A.氯化氢和氢氧化钠都是强电解质,且盐酸和氢氧化钠元数相同,当恰好中和时,二者的物质的量相等;
B.根据图象知,当盐酸中滴加氢氧化钠溶液时,溶液的PH=1,则c(HCl)=0.1mol/L,当氢氧化钠溶液中未滴加盐酸时,溶液的pH=13,则c(NaOH)=0.1mol/L;
C.根据pH变化曲线知,a是氢氧化钠溶液滴定盐酸溶液,b是盐酸滴定氢氧化钠溶液;
D.氢氧化钠与盐酸恰好反应时溶液呈中性,可用酚酞或甲基橙做指示剂.
B.根据图象知,当盐酸中滴加氢氧化钠溶液时,溶液的PH=1,则c(HCl)=0.1mol/L,当氢氧化钠溶液中未滴加盐酸时,溶液的pH=13,则c(NaOH)=0.1mol/L;
C.根据pH变化曲线知,a是氢氧化钠溶液滴定盐酸溶液,b是盐酸滴定氢氧化钠溶液;
D.氢氧化钠与盐酸恰好反应时溶液呈中性,可用酚酞或甲基橙做指示剂.
解答:
解:A.P点时二者恰好完全中和,盐酸是一元强酸,氢氧化钠是一元强碱,当二者恰好中和时,二者反应生成氯化钠,则溶液呈中性,故A正确;
B.根据图象知,当盐酸中未滴加氢氧化钠溶液时,溶液的pH=1,则c(HCl)=10-1 mol/L=0.1mol/L,故B错误;
C.根据图象知,当a曲线发生中和反应时,溶液的pH=1,说明原溶液是盐酸,所以a曲线是氢氧化钠滴定盐酸的实验,故C错误;
D.甲基橙的变色范围是3.1-4.4,酚酞的变色范围是8-10,且变色现象较明显,所以该中和滴定可以用酚酞或甲基橙作指示剂,故D错误.
故选A.
B.根据图象知,当盐酸中未滴加氢氧化钠溶液时,溶液的pH=1,则c(HCl)=10-1 mol/L=0.1mol/L,故B错误;
C.根据图象知,当a曲线发生中和反应时,溶液的pH=1,说明原溶液是盐酸,所以a曲线是氢氧化钠滴定盐酸的实验,故C错误;
D.甲基橙的变色范围是3.1-4.4,酚酞的变色范围是8-10,且变色现象较明显,所以该中和滴定可以用酚酞或甲基橙作指示剂,故D错误.
故选A.
点评:本题考查了酸碱中和滴定实验,根据图中pH变化曲线确定滴定顺序,结合酸碱的性质分析解答,难点是酸碱指示剂的选取方法,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在给定的四种溶液中,加入以下离子,各离子一定能在原溶液中大量共存的是( )
| A、加入铝粉生成氢气的溶液中:MnO4-、C2O42-、Na+、K+ | ||
B、
| ||
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、I-、Br-、Ba2+ | ||
| D、已含Fe3+的溶液:K+、SCN-、NO3-、Al3+ |
下列叙述正确的是( )
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
| B、中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C、0.2 mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、已知难溶物FeS的Ksp=8.1×10-17,FeS饱和溶液中c(H+)2?c(S2-)=1.0×10-22,为使溶液里c(Fe2+)达到了1mol?L-1,应调节溶液中的c(H+)为1.11×10-3mol?L-1 |
下列实验操作中,所用仪器不合理的是( )
| A、在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体 |
| B、用10ml的量筒量取5.2ml的盐酸 |
| C、用托盘天平称取25.2gNaCl |
| D、用50ml容量瓶配制100ml 0.1mol/L的盐酸 |
有一类有机硅化合物中只含有硅元素和氢元素,叫硅烷,它们的分子组成与烷烃相似,其中有一种结构最简单的硅烷叫甲硅烷(SiH4),则有关描述不正确的是( )
| A、硅烷的分子通式可表示为SinH2n+2 |
| B、甲硅烷的稳定性比甲烷强 |
| C、甲硅烷的沸点高于甲烷 |
| D、甲硅烷燃烧生成SiO2和H2O |

 为验证氧化性
为验证氧化性