题目内容
下列各组物质的性质及粒子变化正确的是( )
| A、酸性HClO4>H2SO4>H3PO4>H2CO3 |
| B、稳定性H2S>HCl>HBr>HI |
| C、粒子半径Br->K+>S2->S |
| D、还原性Na>Br->Cl->S2- |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:A.非金属性越强,最高价含氧酸的酸性越强;
B.非金属性越强,气态氢化物越稳定;
C.电子层越多,半径越大;具有相同排布的离子,原子序数大的离子半径小;
D.金属的还原性大于非金属离子的还原性,非金属的氧化性越强,对应离子的还原性越弱.
B.非金属性越强,气态氢化物越稳定;
C.电子层越多,半径越大;具有相同排布的离子,原子序数大的离子半径小;
D.金属的还原性大于非金属离子的还原性,非金属的氧化性越强,对应离子的还原性越弱.
解答:
解:A.非金属性Cl>S>P>C,最高价含氧酸的酸性为HClO4>H2SO4>H3PO4>H2CO3,故A正确;
B.非金属性Cl>S,气态氢化物稳定性为HCl>H2S,故B错误;
C.电子层越多,半径越大;具有相同排布的离子,原子序数大的离子半径小,则半径为粒子半径Br->S2->K+>S,故C错误;
D.金属的还原性大于非金属离子的还原性,非金属的氧化性越强,对应离子的还原性越弱,则还原性为Na>S2->Br->Cl-,故D错误;
故选A.
B.非金属性Cl>S,气态氢化物稳定性为HCl>H2S,故B错误;
C.电子层越多,半径越大;具有相同排布的离子,原子序数大的离子半径小,则半径为粒子半径Br->S2->K+>S,故C错误;
D.金属的还原性大于非金属离子的还原性,非金属的氧化性越强,对应离子的还原性越弱,则还原性为Na>S2->Br->Cl-,故D错误;
故选A.
点评:本题考查同主族、同周期元素性质,为高频考点,把握规律性知识的应用为解答的关键,侧重非金属性及微粒半径、还原性的考查,题目难度中等.

练习册系列答案
相关题目
下列离子反应方程式正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| B、氢氧化铜和稀盐酸溶液反应:H++OH-═H2O |
| C、锌粒溶于醋酸溶液:Zn+2H+═Zn2++H2↑ |
| D、往盐酸中滴加少量Na2CO3溶液:CO32-+2H+═CO2↑+H2O |
有机物 有多种同分异构体,其中属于芳香族化合物且加入FeCl3,溶液显紫色的有( )
有多种同分异构体,其中属于芳香族化合物且加入FeCl3,溶液显紫色的有( )
 有多种同分异构体,其中属于芳香族化合物且加入FeCl3,溶液显紫色的有( )
有多种同分异构体,其中属于芳香族化合物且加入FeCl3,溶液显紫色的有( )| A、6种 | B、4种 | C、3种 | D、2种 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| B、标准状况下,22.4L NH3中含有共价键的数目为NA |
| C、1mol Cl2与足量Fe反应转移电子数一定为3NA |
| D、标准状况下,11.2L SO3所含的分子数目为0.5NA |
下列表述不正确的是( )
| A、福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 |
| B、“低能耗、低污染、低排放”是低碳经济的重要标志,其中“低排放”主要是指减少二氧化碳排放 |
| C、为证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
| D、除去SO2中混有的少量HCl气体,可将气体通过盛有足量饱和NaHSO3溶液的洗气瓶 |
下列实验设计能够成功的是( )
A、检验亚硫酸钠试样是否变质:试样
| ||||||||
B、检验某卤代烃是否是氯代烃:试样
| ||||||||
C、证明酸性条件H2O2氧化性比I2强:NaI溶液
| ||||||||
D、除去氯化钠晶体中少量硝酸钾:试样
|
将30mL 0.5mol?L-1的MgCl2溶液加水稀释到500mL,稀释后溶液中Cl-的物质的量浓度为( )
| A、0.3mol?L-1 |
| B、0.03mol?L-1 |
| C、0.05mol?L-1 |
| D、0.06mol?L-1 |
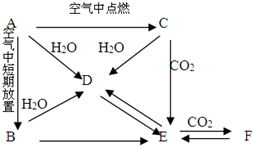 A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.