题目内容
下列反应中,属于氧化还原反应同时又是吸热反应的是( )
| A、Ba(OH)2?8H2O与NH4Cl反应 |
| B、铝与稀盐酸 |
| C、灼热的炭与水蒸气生成一氧化碳和氢气的反应 |
| D、煤与O2的燃烧反应 |
考点:氧化还原反应,吸热反应和放热反应
专题:氧化还原反应专题,化学反应中的能量变化
分析:含元素化合价变化的反应为氧化还原反应,反应物总能量小于生成物总能量,为吸热反应,结合常见的吸热反应来解答.
解答:
解:A.没有元素的化合价变化,为非氧化还原反应,但属于吸热反应,故A不选;
B.Al、H元素的化合价变化,为氧化还原反应,但为放热反应,故B不选;
C.C、H元素的化合价变化,为氧化还原反应,且为吸热反应,故C选;
D.C、O元素的化合价变化,为氧化还原反应,但为放热反应,故D不选;
故选C.
B.Al、H元素的化合价变化,为氧化还原反应,但为放热反应,故B不选;
C.C、H元素的化合价变化,为氧化还原反应,且为吸热反应,故C选;
D.C、O元素的化合价变化,为氧化还原反应,但为放热反应,故D不选;
故选C.
点评:本题考查氧化还原反应及吸热反应,为高频考点,把握反应中元素的化合价变化及能量变化为解答的关键,注意常见的吸热反应,题目难度不大.

练习册系列答案
相关题目
一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的( )
| A、氢氧化钠固体 |
| B、硝酸钠溶液 |
| C、硫酸钾溶液 |
| D、碳酸钠固体 |
A元素的阳离子、B元素的阳离子和C元素的阴离子都具有相同的电子层结构,A的阳离子半径大于B的阳离子半径,则A、B、C三种元素的原子序数由小到大的顺序是( )
| A、A<B<C |
| B、B<C<A |
| C、B<A<C |
| D、C<A<B |
电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )
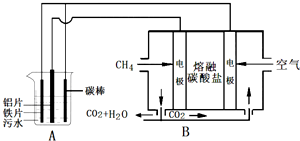

| A、装置A中碳棒为阴极 |
| B、装置B中通入空气的电极反应是O2+2H2O+4e-═4OH- |
| C、污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果 |
| D、标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L |
在0.1mol/L醋酸溶液中,加入锌.以下操作可以使反应速率加快的是( )
| A、滴加少量硫酸铜溶液 |
| B、降低温度 |
| C、加入水 |
| D、加入醋酸钠固体 |
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
下列离子方程式书写正确的是( )
| A、把过量碳酸氢钠溶液加入到氢氧化钡溶液中:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7(常温时):Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、标况下112mL Cl2通入10mL 1mol/L的FeBr2溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
对于VIIA族元素,下列说法不正确的是( )
| A、可形成-l价离子 |
| B、从上到下原子半径逐渐减小 |
| C、从上到下原子半径逐渐增大 |
| D、从上到下非金属性逐渐减弱 |