题目内容
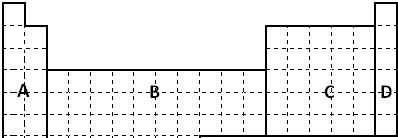
在0.1mol/L醋酸溶液中,加入锌.以下操作可以使反应速率加快的是( )
| A、滴加少量硫酸铜溶液 |
| B、降低温度 |
| C、加入水 |
| D、加入醋酸钠固体 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:升高温度、增大酸的浓度可加快金属和酸的反应速率,而降低温度、减小酸的浓度反应速率减小,此外形成原电池会加快反应速率,以此来解答.
解答:
解:A、滴加少量硫酸铜溶液会形成锌、铜原电池,加快化学反应速率,故A正确;
B、降低温度,化学反应速率减慢,故B错误;
C、加入水,会降低酸的浓度,反应速率减慢,故C错误;
D、加入醋酸钠会对醋酸的电离起到抑制作用,使得电离出的氢离子浓度减少,化学反应速率减慢,故D错误.
故选A.
B、降低温度,化学反应速率减慢,故B错误;
C、加入水,会降低酸的浓度,反应速率减慢,故C错误;
D、加入醋酸钠会对醋酸的电离起到抑制作用,使得电离出的氢离子浓度减少,化学反应速率减慢,故D错误.
故选A.
点评:本题考查影响反应速率的因素,明确浓度、温度对反应速率的影响即可解答,题目难度不大,注意选项D中浓度为主要因素.

练习册系列答案
相关题目
研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化.据此判断以下叙述中错误的是( )
| A、金属钠与氯气反应生成氯化钠后,稳定性增强,体系的能量降低 |
| B、物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C、氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很不活泼 |
| D、需加热才能发生的反应一定是吸收能量的反应 |
有甲、乙、丙三种溶液,进行如图操作,则甲、乙、丙三种溶液可能是( )
Na2CO3溶液
白色沉淀
沉淀溶解并产生气体
产生白色沉淀.
Na2CO3溶液
| 甲 |
| 过量乙 |
| 丙 |
| A、BaCl2、H2SO4、MgCl2 |
| B、CaCl2、HNO3、BaCl2 |
| C、CaCl2、HNO3、NaCl |
| D、BaCl2、HCl、Na2SO4 |
下列反应中,属于氧化还原反应同时又是吸热反应的是( )
| A、Ba(OH)2?8H2O与NH4Cl反应 |
| B、铝与稀盐酸 |
| C、灼热的炭与水蒸气生成一氧化碳和氢气的反应 |
| D、煤与O2的燃烧反应 |
有两个恒容密闭容器甲与乙,甲容器恒温,乙容器绝热,相同情况下投入相同量反应物各自发生反应
A(g)+2B(g)?2C(g);△H<0 达到平衡,下列叙述正确的是( )
A(g)+2B(g)?2C(g);△H<0 达到平衡,下列叙述正确的是( )
| A、甲中A的转化率高 |
| B、恒容时,甲通入惰性气体,反应速率变大 |
| C、甲先达到平衡 |
| D、平衡常数乙大 |
下列能用勒沙特列原理解释的是( )
| A、加入催化剂后H2和O2反应生成水 |
| B、棕红色NO2加压后颜色先变深后变浅 |
| C、SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混和气加压后颜色变深 |
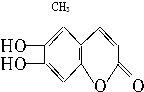 中草药素皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别是( )
中草药素皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别是( )| A、3 mol,2 mol |
| B、3 mol,4 mol |
| C、2 mol,3 mol |
| D、4 mol,4 mol |
在一定条件下,RO3n-和I-发生如下反应:RO3n-+6I-+6H+═R-+3I2+3H2O(R为主族短周期元素),则下列关于R元素的说法中不正确的是( )
| A、RO3n-中R的化合价为+5价,n=1 |
| B、R位于元素周期表中的第VA族 |
| C、R的氢化物的水溶液和它的氧化物的水化物均呈酸性 |
| D、R的最外层电子为7 |