题目内容
对于VIIA族元素,下列说法不正确的是( )
| A、可形成-l价离子 |
| B、从上到下原子半径逐渐减小 |
| C、从上到下原子半径逐渐增大 |
| D、从上到下非金属性逐渐减弱 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题
分析:第VIIA族元素原子最外层电子数为7,素的最低负价=最外层电子数-8,同主族元素从上到下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,以此解答.
解答:
解:A.VIIA族元素原子最外层都为7个电子,易得到1个电子而形成-1价离子,故A正确;
B.同主族元素从上到下原子半径逐渐增大,故B错误;
C.同主族元素从上到下原子半径逐渐增大,故C正确;
D.VIIA族元素从上到下元素的原子半径逐渐增大,原子核对最外层的电子的吸引力逐渐减弱,非金属性逐渐减弱,故D正确.
故选B.
B.同主族元素从上到下原子半径逐渐增大,故B错误;
C.同主族元素从上到下原子半径逐渐增大,故C正确;
D.VIIA族元素从上到下元素的原子半径逐渐增大,原子核对最外层的电子的吸引力逐渐减弱,非金属性逐渐减弱,故D正确.
故选B.
点评:本题考查元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律以及对应单质、化合物的性质的相似性和递变性的判断,把握比较角度,难度不大.

练习册系列答案
相关题目
下列反应中,属于氧化还原反应同时又是吸热反应的是( )
| A、Ba(OH)2?8H2O与NH4Cl反应 |
| B、铝与稀盐酸 |
| C、灼热的炭与水蒸气生成一氧化碳和氢气的反应 |
| D、煤与O2的燃烧反应 |
 在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格.如图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
在2010年温哥华冬季奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格.如图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )| A、X分子中不可能所有原子都在同一平面上 |
| B、X遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色 |
| C、1mol X与足量的浓溴水反应,最多消耗5mol Br2 |
| D、1mol X在一定条件下与足量的氢气反应,最多消耗1mol H2 |
 奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
奥运会中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A、该物质与苯酚属于同系物 |
| B、该物质不能使酸性KMnO4溶液褪色 |
| C、1 mol该物质与浓溴水反应时最多消耗Br2为4 mol |
| D、该分子中的所有原子可能在同一平面 |
可用来鉴别苯酚溶液、乙酸乙酯、乙苯、庚烯的一组试剂是( )
| A、银氨溶液、溴水 |
| B、酸性高锰酸钾溶液、氯化铁溶液 |
| C、酸性高锰酸钾溶液、溴水 |
| D、氯化铁溶液、溴水 |
在一定条件下,RO3n-和I-发生如下反应:RO3n-+6I-+6H+═R-+3I2+3H2O(R为主族短周期元素),则下列关于R元素的说法中不正确的是( )
| A、RO3n-中R的化合价为+5价,n=1 |
| B、R位于元素周期表中的第VA族 |
| C、R的氢化物的水溶液和它的氧化物的水化物均呈酸性 |
| D、R的最外层电子为7 |
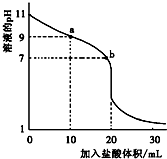 室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A、b点:c(M+)+c(MOH)=c(Cl-) |
| B、a到b点的水溶液导电性依次增强 |
| C、该一元碱溶液浓度为0.100 0 mol?L-1 |
| D、室温下,MOH的电离常数Kb=1×10-5 |
医疗上常用硫酸钡作造影剂,俗称“钡餐”,碳酸钡却不能作钡餐,这是因为( )
| A、硫酸钡不溶于水,碳酸钡能溶于水 |
| B、硫酸钡是强酸盐,碳酸钡是弱酸盐 |
| C、硫酸钡不溶于水不溶于酸,碳酸钡不溶于水也不溶于酸 |
| D、硫酸钡不溶于水不溶于酸,碳酸钡不溶于水但能溶于酸 |
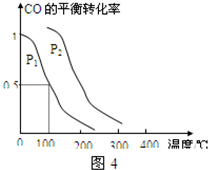
 (4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
(4)在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇CO(g)+2H2(g)═CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: