题目内容
5.填写Fe的氧化物有关项目| 氧化物 | Fe2O3 | Fe3O4 |
| 颜色 | 红色 | 黑色 |
| 溶于盐酸溶液后含有的金属阳离子 | Fe3+ | Fe2+Fe3+ |
分析 Fe2O3为红色固体,Fe元素化合价为+3价,Fe3O4为黑色固体,Fe元素化合价有+2、+3价,以此解答该题.
解答 解:Fe2O3为红色固体,Fe元素化合价为+3价,与盐酸反应生成Fe3+,Fe3O4为黑色固体,Fe元素化合价有+2、+3价,与盐酸反应生成Fe2+Fe3+.
故答案为:红色;Fe3+;Fe2+Fe3+.
点评 本题考查铁化合物的性质,为高频考点,侧重于学生的双基的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
20.向Fe和Fe2O3混合粉末中加入足量稀硫酸,充分反应后生成FeSO4溶液.若生成的Fe2+和H2的物质的量之比为4:1时,则被氧化的Fe与被还原Fe3+的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
10.下列有关实验的操作,正确的是( )
| A. | Fe3+ 的水溶液为棕黄色,可用含SCN-的溶液检验 | |
| B. | 用玻璃棒蘸取溶液,滴在湿润的pH试纸上测定溶液的pH值 | |
| C. | 中和滴定用的锥形瓶用待测溶液润洗C | |
| D. | 除去Fe2O3中混有的少量Al2O3可用盐酸 |
14.下列各组离子中,能在酸性溶液里大量共存,并且溶液呈无色透明的是( )
| A. | Fe3+、K+、S2-、SO42- | B. | Na+、K+、AlO2-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Na+、K+、CO32-、SO42- |
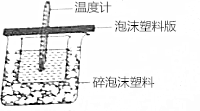 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.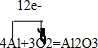 ,红墨水柱右端上升说明这是一个放热反应.
,红墨水柱右端上升说明这是一个放热反应.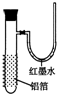
 .
.