题目内容
13.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.写出产生“白毛”的化学方程式并标出电子转移的方向和数目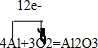 ,红墨水柱右端上升说明这是一个放热反应.
,红墨水柱右端上升说明这是一个放热反应.
分析 铝与硝酸汞的反应是铝能置换出硝酸汞中的汞,据此写出反应的化学方程式;反应放出热量,温度升高,试管中压强增大,由此分析解答.
解答 解:化学性质比较活泼,而汞化学性质不活泼,所以生成的白毛为氧化铝,化学式为Al2O3,反应方程式为: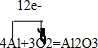 ,由于该反应是放热反应,温度升高后升高中的压强增大,导致红墨水水柱左端下降,右端升高,故答案为:
,由于该反应是放热反应,温度升高后升高中的压强增大,导致红墨水水柱左端下降,右端升高,故答案为: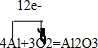 ;这是一个放热反应(反应放出了大量的热).
;这是一个放热反应(反应放出了大量的热).
点评 本题考查了铝的化学性质,铝是活泼的金属,极易被氧化,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.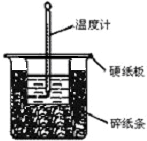 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)要重复进行三次实验的目的是减少实验误差.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是体系内、外温差大,会造成热量损失.
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
(7)三次平行操作所测得的数据如下:
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g•℃),则实验测得的中和热为-39.3kJ/mol.
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)要重复进行三次实验的目的是减少实验误差.
(4)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是体系内、外温差大,会造成热量损失.
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大、偏小、无影响”).
(7)三次平行操作所测得的数据如下:
| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
8.下列关于元素周期表的叙述中,不正确的是( )
| A. | 有七个周期,十八个族 | B. | 是元素周期律的具体表现形式 | ||
| C. | 对工农业生产有一定的指导作用 | D. | 是学习和研究化学的重要工具 |
18.下列离子方程式正确的是( )
| A. | 向澄清石灰水中加入盐酸 Ca(OH)2+2H+→Ca2++2H2O | |
| B. | 硫化亚铁与盐酸反应 S2-+2H+→H2S↑ | |
| C. | 氯化铝溶液与过量氨水反应 Al3++3NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入少量氯气 Fe2++Cl2→Fe3++2Cl- |
5.填写Fe的氧化物有关项目
| 氧化物 | Fe2O3 | Fe3O4 |
| 颜色 | 红色 | 黑色 |
| 溶于盐酸溶液后含有的金属阳离子 | Fe3+ | Fe2+Fe3+ |
2.下列说法正确的是( )
| A. | 金属钠着火可用水扑灭 | |
| B. | 将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 | |
| C. | 向含有等量NaI、NaCl的溶液中逐滴加入AgNO3溶液,先产生浅黄色沉淀 | |
| D. | 用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
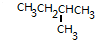 ,则该烃所有可能的结构简式为
,则该烃所有可能的结构简式为 或
或 ;
; .
. 或
或 .
. ,如果要合成
,如果要合成 所用的原始原料可以是AC
所用的原始原料可以是AC