题目内容
18.向20mL 2mol/L AlCl3溶液中加入30mL 5mol/L的NaOH溶液,充分反应后得到白色沉淀,则白色沉淀的质量为( )| A. | 3.12g | B. | 3.9g | C. | 0.78g | D. | 2.34g |
分析 AlCl3的物质的量为:0.02L×2mol/L=0.04mol,NaOH的物质的量为:0.03L×5mol/L=0.15mol,根据反应AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O判断反应过量问题,进而计算得到沉淀的质量.
解答 解:AlCl3的物质的量为:0.02L×2mol/L=0.04mol,NaOH的物质的量为:0.03L×5mol/L=0.15mol,则:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
0.04mol 0.12mol 0.04mol
Al(OH)3+NaOH=NaAlO2+2H2O
0.03mol (0.15-0.0.12)mol
则最后得到的沉淀的质量为:0.04mol-0.03mol=0.01mol,
所以生成白色沉淀的质量为:0.01mol×78g/mol=0.78g,
故选C.
点评 本题考查化学方程式的计算、过量问题的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握根据反应物物质的量判断过量情况的方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
15.通常用来衡量一个国家石油化工发展水平标志的是( )
| A. | 甲烷的产量 | B. | 乙烯的产量 | C. | 乙醇的产量 | D. | 硫酸的产量 |
6.丁醇(C4H10O)与乙二酸(HOOC-COOH)在一定条件下反应,生成的二元酯有( )
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 16种 |
3.下列变化过程中,不需要破坏化学键的是( )
| A. | 食盐溶于水 | B. | 碘的升华 | ||
| C. | 氯气溶于氢氧化钠溶液 | D. | 氢氧化钠受热熔化 |
10.LED产品的使用为城市增添色彩.下图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
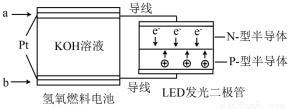

| A. | P一型半导体连接的是电池负极 | |
| B. | b 处通入O2为电池正极,发生了还原反应 | |
| C. | 通入O2的电极发生反应:O2+4e-+4H+=2H2O | |
| D. | 该装置只涉及两种形式的能量转换 |
7.2012年6月16日18点37分21秒,神舟九号载人飞船发射成功,与天宫一号目标飞行器进行首次载人空间交会手控对接,使中国的探月工程又迈出重要的一步.据预测,月球的土壤中吸附着数百万吨的氦23He,可作为未来核聚变的重要原料之一.对23He原子的叙述不正确的是( )
| A. | 质量数是3 | B. | 质子数是3 | C. | 中子数是1 | D. | 电子数是2 |
8.目前,消除氮氧化物污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)△H=-955kJ•mol-1.
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
①写出滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②滴定过程中操作滴定管的图示正确的是A.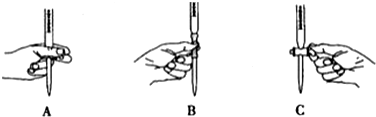
③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
④写出表中a 对应的实验目的探究不同温度对反应速率的影响;
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论.某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间.
⑥该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)△H=-955kJ•mol-1.
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
①写出滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②滴定过程中操作滴定管的图示正确的是A.

③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
⑥该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.