题目内容
20.(1)完成下列离子方程式(已给出的化学计量数不可变动):Fe(OH)3+3H+═Fe3++3H2O(2)各写出一个符合以下离子方程式的化学方程式:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓BaCl2+H2SO4═BaSO4↓+H2O
(3)写出下列反应的离子方程式:
①硫酸镁溶液与氢氧化钡溶液反应:②氢氧化铜溶于稀硝酸中:
(4)NaBrO3是一种分析试剂.向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
分析 (1)与酸反应后生成铁离子,则反应前未知物为氧化铁或氢氧化铁,根据消耗氢离子判断反应物;
(2)该反应为可溶性钡盐与硫酸或可溶性硫酸盐的反应;
(3)①硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡;
②氢氧化铜和稀硝酸反应生成硝酸铜和水;
(4)根据离子反应情况以及电子守恒来计算.
解答 解:(1)由反应后生成铁离子,则反应为氧化铁或氢氧化铁与酸反应,氧化铁与氢离子反应为:Fe2O3+6H+═2Fe3++3H2O,则该反应物为Fe(OH)3,
故答案为:Fe(OH)3;3H2O;
(2)Ba2++SO42-═BaSO4↓中保留化学式的只有硫酸钡,其它物质都是易溶强电解质,满足体积的化学方程式如:BaCl2+H2SO4═BaSO4↓+H2O,
故答案为:BaCl2+H2SO4═BaSO4↓+H2O;
(3))①硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡,离子方程式为Mg2++2OH-+Ba2++SO42-=BaSO4↓+Mg(OH)2↓,
故答案为:Mg2++2OH-+Ba2++SO42-=BaSO4↓+Mg(OH)2↓;
②氢氧化铜和稀硝酸反应生成硝酸铜和水,反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;
(4)2.6mol NaBrO3反应生成溴单质时转移的电子数为2.6×5=13mol,生成碘为0.5mol,转移的电子为1mol,则生成IO3-转移的电子数为12mol,生成IO3-的物质的量为2mol,根据碘原子守恒,则原溶液中NaI的物质的量为2+1=3mol,
故答案为:3.
点评 本题考查较为综合,涉及氧化还原反应的计算、离子方程式、化学方程式书写,题目难度中等,注意掌握电子守恒在氧化还原反应的计算中的应用,明确离子方程式、化学方程式的书写原则,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.

| A. | 7.8gNa2O2中含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物中含离子总数为0.3NA | |
| C. | 7.8gNa2O2与足量的CO2充分反应,产生O2的分子总数为0.1NA | |
| D. | 0.2molNa被完全氧化生成7.8gNa2O2,转移的电子数目为0.1NA |
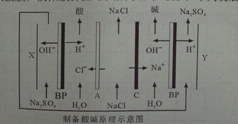
| A. | A为阳离子交换膜,C为阴离子交换膜 | |
| B. | X为阴极,发生的电极反应方程式为:4OH--4e-=O2↑+2H2O | |
| C. | 在X、Y极室加入Na2SO4,目的是提供制备的酸和碱的阳离子或阴离子 | |
| D. | 通过该装置,不但海水得到了淡化,同时还可以得到NaOH、HCl、H2、O2等物质 |
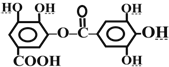
| A. | 该有机物的分子式为C14H10O9 | |
| B. | 常温下,与Na2CO3溶液反应放出CO2 | |
| C. | 与稀H2SO4共热,生成两种有机物 | |
| D. | 能发生碱性水解,1mol该有机物完全反应消耗8molNaOH |
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量 |

 ;
;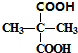 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 .
. 、
、 .
.