题目内容
8.双级膜电渗析解离NaCl溶液制备酸碱的原理,为提高海水淡化的附加值提供了新的技术路径.已知BP为双级膜,阴阳膜界面可以解离H+和OH-,下列说法正确的是( )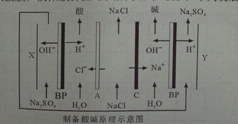
| A. | A为阳离子交换膜,C为阴离子交换膜 | |
| B. | X为阴极,发生的电极反应方程式为:4OH--4e-=O2↑+2H2O | |
| C. | 在X、Y极室加入Na2SO4,目的是提供制备的酸和碱的阳离子或阴离子 | |
| D. | 通过该装置,不但海水得到了淡化,同时还可以得到NaOH、HCl、H2、O2等物质 |
分析 A、A是氯离子通过,而B是钠离子自由通过;
B、X为阳极,而不是阴极;
C、在X、Y极室加入Na2SO4,目的是增加溶液的导电性;
D、该装置是氯化钠的浓度减少,同时在阴极得到氢气阳极得到氧气.
解答 解:A、A是氯离子通过,而B是钠离子自由通过,所以A为阴离子交换膜,C为阳离子交换膜,故A错误;
B、X为阳极,而不是阴极,电极反应式为:4OH--4e-=O2↑+2H2O,故B错误;
C、在X、Y极室加入Na2SO4,目的是增加溶液的导电性,而不是提供制备的酸和碱的阳离子或阴离子,故C错误;
D、该装置是氯化钠的浓度减少,同时在阴极得到氢气阳极得到氧气,所以通过该装置,不但海水得到了淡化,同时还可以得到NaOH、HCl、H2、O2等物质,故D正确;
故选D.
点评 本题考查了海水淡化原理,明确图片内涵是解本题关键,阴阳离子在电极上放电,导致排出的水为淡水,从而实现海水淡化,难度不大.

练习册系列答案
相关题目
20.在通常条件下,下列各组物质的熔点排列正确的是( )
| A. | SiC>C(金刚石)>Si | B. | Al>Mg>Na | C. | H2O>H2Se>H2S | D. | KCl>NaCl>LiCl |
3.生活中遇到的某些问题常常涉及到化学知识,下列叙述不正确的是( )
| A. | 苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用 | |
| B. | 工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目失明甚至死亡 | |
| C. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 | |
| D. | 不粘锅的表面涂有聚四氟乙烯 |
20.(1)完成下列离子方程式(已给出的化学计量数不可变动):Fe(OH)3+3H+═Fe3++3H2O
(2)各写出一个符合以下离子方程式的化学方程式:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓BaCl2+H2SO4═BaSO4↓+H2O
(3)写出下列反应的离子方程式:
①硫酸镁溶液与氢氧化钡溶液反应:②氢氧化铜溶于稀硝酸中:
(4)NaBrO3是一种分析试剂.向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为
则原溶液中NaI的物质的量为3 mol.
(2)各写出一个符合以下离子方程式的化学方程式:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓BaCl2+H2SO4═BaSO4↓+H2O
(3)写出下列反应的离子方程式:
①硫酸镁溶液与氢氧化钡溶液反应:②氢氧化铜溶于稀硝酸中:
(4)NaBrO3是一种分析试剂.向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
17.能正确表示下列反应的离子方程式是( )
| A. | 纯碱溶液中逐滴加少量盐酸:CO32-+H+═HCO3- | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| C. | 向FeBr2溶液中通入过量Cl2的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
15.下列物质中,属于纯净物的是( )
| A. | 碱石灰 | B. | 生石灰 | C. | 汽油 | D. | 铝热剂 |