题目内容
(1)写出下列反应的化学方程式
铁与高温水蒸气反应
镁条在CO2中燃烧
铝粉在四氧化三铁反应
(2)写出下列反应的离子方程式
石灰水中通CO2气体至产生白色沉淀
碳酸氢钠与盐酸反应
CO2与足量烧碱溶液反应
(3)胃液中含盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量小苏打(NaHCO3),能治疗胃酸过多,其反应的离子方程式是 ;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含氢氧化铝的胃药(如胃舒平).反应的离子方程式是 .
(4)标出下列反应中电子转移的方向与数目3Cu2S+16HNO3=3CuSO4+3Cu(NO3)2+10NO↑+8H2O.
铁与高温水蒸气反应
镁条在CO2中燃烧
铝粉在四氧化三铁反应
(2)写出下列反应的离子方程式
石灰水中通CO2气体至产生白色沉淀
碳酸氢钠与盐酸反应
CO2与足量烧碱溶液反应
(3)胃液中含盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量小苏打(NaHCO3),能治疗胃酸过多,其反应的离子方程式是
(4)标出下列反应中电子转移的方向与数目3Cu2S+16HNO3=3CuSO4+3Cu(NO3)2+10NO↑+8H2O.
考点:离子方程式的书写,化学方程式的书写,氧化还原反应
专题:氧化还原反应专题,元素及其化合物
分析:(1)铁与高温水蒸气反应生成四氧化三铁和氢气;
镁条与二氧化碳发生置换反应生成氧化镁和碳单质;
铝粉与四氧化三铁发生铝热反应;
(2)石灰石与少量的二氧化碳反应生成碳酸钙;
碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
CO2与足量烧碱溶液反应生成碳酸钠和水;
(3)胃液的主要成分是盐酸,服用适量小苏打(NaHCO3)发生反应消耗氢离子生成氯化钠、水和二氧化碳;
胃舒平中含有氢氧化铝,与盐酸反应生成氯化铝和水;
(4)先找化合价变化的元素,再标出电子转移的方向和数目,在氧化还原反应中,化合价升高元素所在的反应物是还原剂.
镁条与二氧化碳发生置换反应生成氧化镁和碳单质;
铝粉与四氧化三铁发生铝热反应;
(2)石灰石与少量的二氧化碳反应生成碳酸钙;
碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
CO2与足量烧碱溶液反应生成碳酸钠和水;
(3)胃液的主要成分是盐酸,服用适量小苏打(NaHCO3)发生反应消耗氢离子生成氯化钠、水和二氧化碳;
胃舒平中含有氢氧化铝,与盐酸反应生成氯化铝和水;
(4)先找化合价变化的元素,再标出电子转移的方向和数目,在氧化还原反应中,化合价升高元素所在的反应物是还原剂.
解答:
解:(1)铁与高温水蒸气反应的化学方程式:3Fe+4H2O(g)
Fe3O4+4H2,镁条与二氧化碳反应的化学方程式:2Mg+CO2
2MgO+C,
铝粉与四氧化三铁反应的化学方程式为:8Al+3Fe3O4
9Fe+4Al2O3,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2 ;2Mg+CO2
2MgO+C;8Al+3Fe3O4
9Fe+4Al2O3;
(2)石灰水中通CO2气体至产生白色沉淀,反应的离子方程式为:Ca2++CO2+2OH-═CaCO3↓+H2O,
碳酸氢钠与盐酸反应的离子方程式为:H++HCO3-=H2O+CO2↑;
CO2与足量烧碱溶液反应的离子方程式为:CO2+2OH-=CO32-+H2O;
故答案为:Ca2++CO2+2OH-═CaCO3↓+H2O;H++HCO3-=H2O+CO2↑;CO2+2OH-=CO32-+H2O;
(3)碳酸氢钠与盐酸反应生成二氧化碳、氯化钠和水,反应的离子方程式为:HCO3-+H+=CO2↑+H2O;
氢氧化铝与盐酸发生酸碱中和反应,离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:HCO3-+H+=CO2↑+H2O;Al(OH)3+3H+=Al3++3H2O;
(4)在反应3Cu2S+16HNO3=3CuSO4+3Cu(NO3)2+10NO↑+8H2O中,铜元素、硫元素化合价均升高,所以硫化亚铜为还原剂,硝酸中的氮元素部分化合价降低,硝酸为氧化剂,电子转移情况如图所示为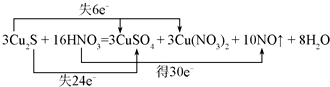 ,
,
故答案为: .
.
| ||
| ||
铝粉与四氧化三铁反应的化学方程式为:8Al+3Fe3O4
| ||
故答案为:3Fe+4H2O(g)
| ||
| ||
| ||
(2)石灰水中通CO2气体至产生白色沉淀,反应的离子方程式为:Ca2++CO2+2OH-═CaCO3↓+H2O,
碳酸氢钠与盐酸反应的离子方程式为:H++HCO3-=H2O+CO2↑;
CO2与足量烧碱溶液反应的离子方程式为:CO2+2OH-=CO32-+H2O;
故答案为:Ca2++CO2+2OH-═CaCO3↓+H2O;H++HCO3-=H2O+CO2↑;CO2+2OH-=CO32-+H2O;
(3)碳酸氢钠与盐酸反应生成二氧化碳、氯化钠和水,反应的离子方程式为:HCO3-+H+=CO2↑+H2O;
氢氧化铝与盐酸发生酸碱中和反应,离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:HCO3-+H+=CO2↑+H2O;Al(OH)3+3H+=Al3++3H2O;
(4)在反应3Cu2S+16HNO3=3CuSO4+3Cu(NO3)2+10NO↑+8H2O中,铜元素、硫元素化合价均升高,所以硫化亚铜为还原剂,硝酸中的氮元素部分化合价降低,硝酸为氧化剂,电子转移情况如图所示为
 ,
,故答案为:
 .
.
点评:本题考查了化学方程式、离子方程式、氧化还原反应的表示方法,题目难度不大,明确反应的实质是书写化学方程式、离子方程式的关键,用双线桥表示氧化还原反应的关键在于准确的判断元素化合价的变化.

练习册系列答案
相关题目
请回忆食盐晶体的晶胞结构,已知食盐的密度为ρ g?cm-3,其摩尔质量为M g?mol-1,阿伏加德罗常数为NA,则在食盐晶体中Na+和Cl-的核间距大约是( )
A、
| |||||
B、
| |||||
C、
| |||||
D、
|
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图所示,下列说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图所示,下列说法正确的是( )| A、B为电源的正极 |
| B、电解过程中,阳极室附近的PH保持不变 |
| C、电解过程中,电子由电源B端流出经溶液流回到电源A端 |
| D、右边发生的电极反应式为:2H2O+2e-═H2↑+2OH- |



 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
 和
和 ⑥
⑥ 和
和