题目内容
物质A-E都是中学化学中常见的物质,它们可以发生如下图所示的反应,其中E是蓝色溶液.

(1)在以上反应中(用序号填空),属于氧化还原反应的是 ,属于离子反应的是 .
(2)写出反应③的离子方程式: .
(3)反应⑦的速率如上图,其原因可能是 .
(4)从上述框图中选取电极材料和电解质溶液组成原电池,其中正极材料是 .负极反应为 .

(1)在以上反应中(用序号填空),属于氧化还原反应的是
(2)写出反应③的离子方程式:
(3)反应⑦的速率如上图,其原因可能是
(4)从上述框图中选取电极材料和电解质溶液组成原电池,其中正极材料是
考点:无机物的推断
专题:推断题
分析:E是蓝色溶液,应为CuSO4,由转化关系可反应的条件可知,D+H2=A,E+Fe=A,判断A为Cu,D为CuO,B为CuCl2,C为Cu(OH)2,结合对应的物质的性质以及题目要求可解答该题.
解答:
解:E是蓝色溶液,应为CuSO4,由转化关系可反应的条件可知D为CuO,A为Cu,B为CuCl2,C为Cu(OH)2,
(1)由以上分析可知A为Cu,B为CuCl2,C为Cu(OH)2,D为CuO,E为CuSO4;
题中①②⑦有元素化合价的变化,属于氧化还原反应,③④⑤⑦为溶液中的反应,属于离子反应,
故答案为:①②⑦;③④⑤⑦;
(2)反应③为氧化铜和硫酸的反应,反应的离子方程式为CuO+2H+═Cu2++H2O,
故答案为:CuO+2H+═Cu2++H2O;
(3)在硫酸铜中加入铁,置换出铜,形成形成Fe-Cu原电池,反应速率加快,
故答案为:形成Fe-Cu原电池,反应速率加快;
(4)依据原电池眼眶里分析,转化关系中选取铁铜做电极,稀硫酸做电解质溶液,形成原电池反应Fe+H2SO4=FeSO4+H2↑,正极材料为铜,负极材料是铁,负极电极反应为:Fe-2e-=Fe2+;
故答案为:Cu;Fe-2e-=Fe2+.
(1)由以上分析可知A为Cu,B为CuCl2,C为Cu(OH)2,D为CuO,E为CuSO4;
题中①②⑦有元素化合价的变化,属于氧化还原反应,③④⑤⑦为溶液中的反应,属于离子反应,
故答案为:①②⑦;③④⑤⑦;
(2)反应③为氧化铜和硫酸的反应,反应的离子方程式为CuO+2H+═Cu2++H2O,
故答案为:CuO+2H+═Cu2++H2O;
(3)在硫酸铜中加入铁,置换出铜,形成形成Fe-Cu原电池,反应速率加快,
故答案为:形成Fe-Cu原电池,反应速率加快;
(4)依据原电池眼眶里分析,转化关系中选取铁铜做电极,稀硫酸做电解质溶液,形成原电池反应Fe+H2SO4=FeSO4+H2↑,正极材料为铜,负极材料是铁,负极电极反应为:Fe-2e-=Fe2+;
故答案为:Cu;Fe-2e-=Fe2+.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力、推断能力和综合运用元素化合物知识,注意把握题给信息,找出推断的突破口,把握相关物质的性质以及离子方程式、化学方程式的书写,难度中等.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列变化过程中,共价键被破坏的是( )
| A、烧碱溶于水 |
| B、二氧化碳变成干冰 |
| C、氯化氢气体遇到氨气产生白烟 |
| D、碘溶于酒精 |
下列关于浓硫酸的说法正确的是( )
| A、浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B、浓硫酸在常温下可迅速与铜片反应而放出二氧化硫 |
| C、浓硫酸是一种干燥剂,能用来干燥氨气、氢气 |
| D、浓硫酸在常温下能够使铁铝钝化 |
试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是( )
| A、试管外壁有水珠不一定要擦干,加热时会自然挥发 | ||
| B、应握紧试管夹,大拇指按在短柄上 | ||
C、试管中液体的量不能超过试管容积的
| ||
| D、可以使试管的受热部位在火焰上方先上下移动,后集中加热 |
下列叙述正确的是( )
| A、离子化合物中可能含有共价键 |
| B、共价化合物中可能还有离子键 |
| C、两种元素组成的分子中一定只有极性键 |
| D、非金属元素组成的化合物一定是共价化合物 |
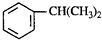 ) ⑧乙炔.按下列要求填空:
) ⑧乙炔.按下列要求填空: 实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置,实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意效果.
实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置,实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意效果.