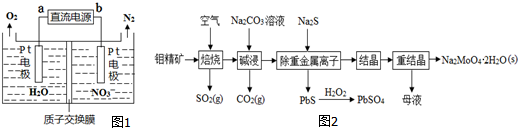
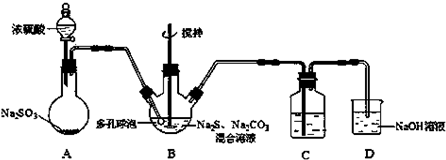
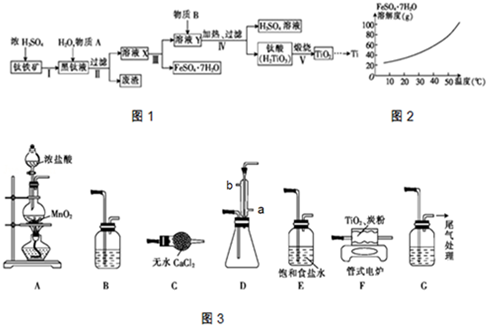
题目内容
1.在一定温度下,将0.20mol 的四氧化二氮气体充入1L的固定的密闭容器中,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:时间 (s)浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为:N2O4?2NO2,表示C2>C3=C4 (填<,>或=)
(2)20s时,四氧化二氮的浓度C1=0.14mol/L,在0~20s内四氧化二氮的平均反应速度为0.003mol/(L•s).
分析 (1)依据图表数据分析,反应物和生成物分析判断;由表可知,60s时反应达平衡,反应混合物各组分的浓度不变;
(2)化学平衡的三行式列式计算,结合化学反应速率概念计算0~20s内N2O4的平均反应速率.
解答 解:(1)反应的化学方程式为:N2O4?2NO2,由表可知,60s时反应达平衡,c(NO2)=0.22mol/L,消耗的N2O4浓度为0.11mol/L,60s后反应达平衡,反应混合物各组分的浓度不变,所以C3=C4=C5=0.20mol/L-0.11mol/L=0.09mol,40s时:
N2O4?2NO2,
0.2mol/L 0
0.1mol/L 0.2mol/L
0.1mol/L C2=0.2mol/L
C2=0.2mol/L>C3=C4=C5=0.09mol/L;
故答案为:N2O4?2NO2;>;=;
(2)进行到20s:N2O4 ?2NO2
起始量(mol/L)0.20 0
变化量(mol/L)0.06 0.12
20s末(mol/L) 0.14 0.12
20s时,N2O4的浓度=C1=0.14mol/L;
0~20s内N2O4的平均反应速率=$\frac{0.06mol/L}{20s}$=0.003mol/(L•s),
故答案为:0.14mol/L;0.003mol/(L•s).
点评 本题考查了化学平衡以及化学反应速率的计算,掌握三行式是解题的关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.交警用于检测司机是否酒后开车的检测仪中含有的一种成份是重铬酸钾(K2Cr2O7),其中铬元素的化合价是( )
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
11.某化合物的化学式为C4H9Cl,它的可能的结构有几种( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |