题目内容
一个原电池的总反应为Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
| A、正极 Zn 负极 Cu 电解质溶液 CuCl2 |
| B、正极Cu 负极Zn 电解质溶液 CuCl2 |
| C、正极Zn 负极Cu 电解质溶液 ZnCl2 |
| D、正极Cu 负极Zn 电解质溶液 ZnCl2 |
考点:原电池和电解池的工作原理
专题:
分析:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,作负极;不如锌活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,则电解质溶液中应含有铜离子,所以应为可溶性的铜盐.
解答:
解:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,作负极;不如锌活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,则电解质溶液中应含有铜离子,所以应为可溶性的铜盐,故选B.
点评:本题考查了原电池原理,难度不大,明确原电池的构成条件是解本题关键,注意根据方程式中发生的反应类型判断原电池的正负极及电解质溶液.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
反应2A+3B=C+2D在2L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol,则此反应的平均速率表达正确的是( )
| A、v(C)=0.01 mol?L-1?s-1 |
| B、v(B)=0.03 mol?L-1?s-1 |
| C、v(A)=0.01 mol?L-1?s-1 |
| D、v(D)=0.02 mol?L-1?s-1 |
X、Y、Z是分别位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W.下列推测正确的是( )
| A、元素Z的氧化物一定属于碱性氧化物 |
| B、原子半径关系是:X<Y<Z |
| C、三种元素中,Y的金属性最强 |
| D、Y、Z都能形成含氧酸,且前者的酸性比后者酸性强 |
与4.4g二氧化碳所含原子数相同的一氧化碳的质量是( )
| A、1.5 g |
| B、3.0 g |
| C、4.2 g |
| D、9.0 g |
下列关于反应热的表述正确的是( )
| A、当△H为“-”时,表示该反应为放热反应 | ||
B、已知C(s)+
| ||
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | ||
| D、1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3 |
下列说法正确的是( )
| A、离子化合物中一定含有离子键 |
| B、含有共价键的化合物一定是共价化合物 |
| C、强电解质与弱电解质的划分标准是电解质在水溶液中导电能力的强弱 |
| D、氧气中氧元素的化合价为0,所以氧分子中没有化学键 |
如图是高中化学教科书中元素周期表的一部分,下列说法中正确的是( )
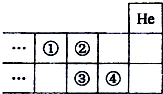

| A、①的气态氢化物比②的稳定 |
| B、②的最高价含氧酸的酸性比③强 |
| C、③的非金属性比④强 |
| D、④的原子半径比③小 |
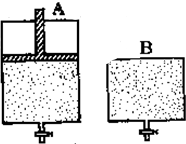 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).