题目内容
为了测定某有机物的分子结构做了如下测试:
(1)取样品14.9克在空气中燃烧,并将生成的产物依次通过浓硫酸和碱石灰,测得浓硫酸增重4.5克,碱石灰增重17.6克.
(2)取与上述等量的样品,先加入足量的NaOH溶液并加热,充分反应后加入足量的稀硝酸,然后再加入AgNO3溶液,测得生成淡黄色沉淀18.8克
(3)实验测得该有机物的蒸气在同温同压下的密度是氢气密度的74.5倍.
(4)实验测得该有机物能发生银镜反应.
(5)仪器测定该有机物不含脂环,含有支链
根据以上信息,完成以下各空:
(1)分子式:
(2)可能的结构简式: .
(1)取样品14.9克在空气中燃烧,并将生成的产物依次通过浓硫酸和碱石灰,测得浓硫酸增重4.5克,碱石灰增重17.6克.
(2)取与上述等量的样品,先加入足量的NaOH溶液并加热,充分反应后加入足量的稀硝酸,然后再加入AgNO3溶液,测得生成淡黄色沉淀18.8克
(3)实验测得该有机物的蒸气在同温同压下的密度是氢气密度的74.5倍.
(4)实验测得该有机物能发生银镜反应.
(5)仪器测定该有机物不含脂环,含有支链
根据以上信息,完成以下各空:
(1)分子式:
(2)可能的结构简式:
考点:有机物实验式和分子式的确定
专题:烃及其衍生物的燃烧规律
分析:(1)由该有机物蒸汽对氢气的相对密度求出其摩尔质量,进而计算得出14.9g该有机物的物质的量;浓硫酸增重4.5g为水的质量,碱石灰增重17.6g为生成二氧化碳,计算二氧化碳和水的物质的量,计算分子中C、H原子数目,再结合相对分子质量计算O原子数目,据此确定R的分子式;
(2)根据该有机物分子式及具有的化学性质书写可能的结构.
(2)根据该有机物分子式及具有的化学性质书写可能的结构.
解答:
解:(1)该有机物的蒸气密度是相同条件下H2密度的74.5倍,则该有机物的相对分子质量为74.5×2=149,
14.9g有机物的物质的量为:
=0.1mol,
浓硫酸增重4.5g为水的质量,n(H2O)=
=0.25mol,n(H)=2n(H2O)=0.5mol,
则该有机物中含有H原子的个数为
=5,
碱石灰增重的17.6g为反应生成的二氧化碳的质量,则n(CO2)=
=0.4mol,n(C)=n(CO2)=0.3mol,则该有机物中含有C原子的个数为:
=4,
生成淡黄色沉淀18.8克为溴化银,物质的量为
=0.1mol,
则该有机物中含有溴原子的个数为
=1,
分子中氧原子数目为:
=1,
故该有机物的分子式为C4H5BrO,故答案为:C4H5BrO;
(2)有机物能发生银镜反应说明含有醛基,不含脂环,含有支链,其可能的结构简式为:CHBr=C(CH3)CHO、CH2=C(CH2Br)CHO,故答案为:CHBr=C(CH3)CHO;CH2=C(CH2Br)CHO.
14.9g有机物的物质的量为:
| 14.9g |
| 149g/mol |
浓硫酸增重4.5g为水的质量,n(H2O)=
| 4.5g |
| 18g/mol |
则该有机物中含有H原子的个数为
| 0.5mol |
| 0.1mol |
碱石灰增重的17.6g为反应生成的二氧化碳的质量,则n(CO2)=
| 17.6g |
| 44g/mol |
| 0.4mol |
| 0.1mol |
生成淡黄色沉淀18.8克为溴化银,物质的量为
| 18.8g |
| 188g/mol |
则该有机物中含有溴原子的个数为
| 0.1mol |
| 0.1mol |
分子中氧原子数目为:
| 149-12×4-5-80 |
| 16 |
故该有机物的分子式为C4H5BrO,故答案为:C4H5BrO;
(2)有机物能发生银镜反应说明含有醛基,不含脂环,含有支链,其可能的结构简式为:CHBr=C(CH3)CHO、CH2=C(CH2Br)CHO,故答案为:CHBr=C(CH3)CHO;CH2=C(CH2Br)CHO.
点评:本题考查有机物分子式与结构简式的确定、同分异构体书写等,题目难度中等,根据原子守恒计算确定有机物的分子式是关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列各种醇既可发生消去反应,又可被氧化成相应醛的是( )
| A、CH3OH |
| B、HOCH2CH2CH3 |
| C、CH3CHOHCH3 |
| D、(CH3)3COH |
用分液漏斗可以分离的一组物质是( )
| A、苯和醋酸钠溶液 |
| B、苯酚和乙醇 |
| C、乙酸和乙醇 |
| D、植物油和乙酸乙酯 |
某有机物链状分子中含a个甲基,n个亚甲基(-CH2-),m个次甲基( ),其余为氯原子.则氯原子的个数为( )
),其余为氯原子.则氯原子的个数为( )
 ),其余为氯原子.则氯原子的个数为( )
),其余为氯原子.则氯原子的个数为( )| A、2n+3m-a |
| B、n+m+a |
| C、m+2-a |
| D、m+2n+2-a |
将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后溶液中离子浓度的关系正确( )
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到4mol Fe(OH)3沉淀,此间共消耗水的物质的量为( )
| A、8 mol |
| B、10 mol |
| C、11 mol |
| D、12 mol |


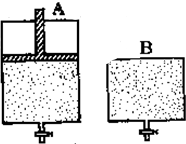 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).