题目内容
8.实验室需配置100mL2.00mol/LNaCl溶液,请你参与实验过程,并完成相关实验报告(填写表格中横线上数字序号所示内容).| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100ml容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、 引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
分析 实验仪器:依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
实验步骤:配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,依据m=CVM计算需要溶质的质量,结合配制步骤解答;
思考与探究:依据玻璃棒在溶解、移液操作中作用解答;
分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:实验仪器:
配制100mL2.00mol/LNaCl溶液,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,需要的仪器:托盘天平、药匙、烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管,缺少的为:100mL容量瓶;
故答案为:100容量瓶;
实验步骤:
配置100mL2.00mol/LNaCl溶液,需要溶质的质量m=2.00moL/L×58.5g/mol×0.1L=11.7g;
故答案为:11.7;
配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,所以缺少的(5)为定容;
故答案为:定容;
思考与探究:
玻璃棒在溶解过程中作用为搅拌加速溶解,在移液过程中作用为引流;
故答案为:引流;
(2)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏低,所配置溶液是浓度<2.00mol/L;
故答案为:<;
点评 本题考查了一定物质的量浓度溶液的配制、仪器的选择以及误差分析,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用注意事项,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.在碘水中加入适量的CCl4振荡后,观察到的现象为( )
| A. | 上层液体呈紫红色 | B. | 下层液体呈褐色 | ||
| C. | 上层液体呈深褐色 | D. | 下层液体呈紫红色 |
19.下列属于物理变化的是( )
| A. | 石油的分馏 | B. | 淀粉水解 | C. | 蛋白质水解 | D. | 煤的干馏 |
3.下列四种基本类型的反应中,一定是氧化还原反应的是( )
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
13.下列化学用语正确的是( )
| A. | 氮分子的电子式: | B. | 溴化钠的电子式: | ||
| C. | 硫原子的结构示意图: | D. | 水分子的结构式: |
6.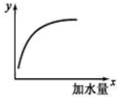 如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )
如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )
 如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )
如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )| A. | c(H+)或 c(OH-) | B. | HA的电离平衡常数Ka | ||
| C. | c(H+)/c(HA) | D. | n(H+)或 n(OH-) |
7.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| A. | 1.4mol•L-1 | B. | 1.2mol•L-1 | C. | 1.1mol•L-1 | D. | 1.0mol•L-1 |

 ⑤
⑤ ⑥HOCH2CH2CH2COOH
⑥HOCH2CH2CH2COOH