题目内容
7.已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )| A. | 1.4mol•L-1 | B. | 1.2mol•L-1 | C. | 1.1mol•L-1 | D. | 1.0mol•L-1 |
分析 已知:还原性强弱:I->Fe2+,所以氯气先氧化碘离子,再氧化亚铁离子,根据离子方程式计算.
解答 解:已知:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,发生反应离子方程式为:
Cl2+2Fe2+=2Cl-+2Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$cV=0.1cmol,
反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol,
解得:c=1.2mol/L,
故选B.
点评 本题主要考查学生氧化还原反应的有关计算,注意溶液中离子反应的顺序,根据离子方程式计算,难度不大.

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
8.实验室需配置100mL2.00mol/LNaCl溶液,请你参与实验过程,并完成相关实验报告(填写表格中横线上数字序号所示内容).
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100ml容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、 引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
18.下列元素在自然界中仅以化合态存在的是( )
①Si ②Al ③Cl ④Fe ⑤Na.
①Si ②Al ③Cl ④Fe ⑤Na.
| A. | ①②⑤ | B. | ①② | C. | ①②③ | D. | ①②③⑤ |
2.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-4种阴离子.向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
| A. | CH3COO- | B. | SO32- | C. | CO32- | D. | HCO3- |
12.已知溶质质量分数为96%的酒精溶液的物质的量浓度为16.6•mol•L-1,则8.3mol•L-1的酒精溶液的溶质的质量分数为( )
| A. | 大于48% | B. | 等于48% | C. | 小于48% | D. | 无法确定 |
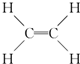
19.在分子 中,在同一平面内的碳原子最少应有( )
中,在同一平面内的碳原子最少应有( )
 中,在同一平面内的碳原子最少应有( )
中,在同一平面内的碳原子最少应有( )| A. | 7个 | B. | 8个 | C. | 9个 | D. | 14个 |
17.有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
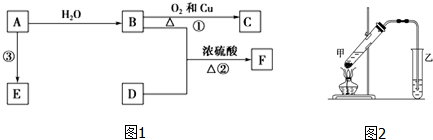
 ,B中决定其性质的重要官能团的名称为羟基.
,B中决定其性质的重要官能团的名称为羟基. 太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.