题目内容
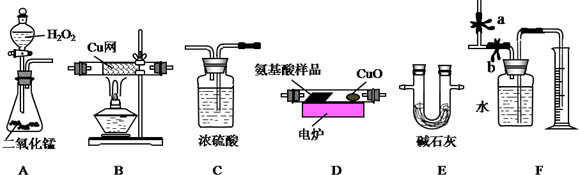
20.下列实验操作不正确的是( )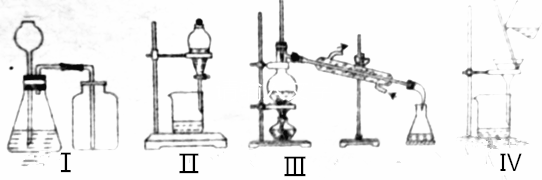
| A. | 选择装置Ⅰ用铜与浓硝酸反应制备NO2 | |
| B. | 选择装置Ⅱ分离乙酸乙酯和饱和碳酸氢钠溶液的混合物 | |
| C. | 选择装置Ⅲ分离对硝酸甲苯和邻硝基甲苯 | |
| D. | 选择装置Ⅳ分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物 |
分析 A.Cu和浓硝酸反应生成二氧化氮且不需要加热,需要固液混合不加热型装置,二氧化氮和空气不反应且密度大于空气,可以采用向上排空气法收集;
B.互不相溶的液体可以采用分液方法分离;
C.互溶的液体可以采用蒸馏方法分离,且温度计测量馏分温度;
D.分离不溶的固体和溶液采用过滤方法.
解答 解:A.Cu和浓硝酸反应生成二氧化氮且不需要加热,需要固液混合不加热型装置,二氧化氮和空气不反应且密度大于空气,可以采用向上排空气法收集,但装置I中浓硝酸具有挥发性,所以生成的二氧化氮中含有硝酸,收集二氧化氮气体之前应该除去硝酸,故A错误;
B.互不相溶的液体可以采用分液方法分离,乙酸乙酯和饱和碳酸钠溶液不互溶,所以可以采用分液方法分离,故B正确;
C.互溶的液体可以采用蒸馏方法分离,且温度计测量馏分温度,温度计水银球位于蒸馏烧瓶支管口处,且冷凝管中下口为进水口、上口为出水口,故C正确;
D.分离不溶的固体和溶液采用过滤方法,所以分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物可以采用过滤方法,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查物质分离和提纯及气体制备,明确实验原理及实验基本操作方法是解本题关键,会根据物质性质差异性选取合适的分离提纯方法,用于物质分离提纯的方法还有渗析、蒸发结晶等,题目难度不大,易错选项是A.

练习册系列答案
相关题目
10.某溶液中含有Cl-、CO32-、HCO3-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Ca(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加HNO3溶液.
①滴加Ca(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加HNO3溶液.
| A. | ①②④③ | B. | ④①②③ | C. | ③②①②④ | D. | ④③②① |
11.四份相同质量的铝与足量下列物质发生反应,能放出氢气且消耗溶质物质的量最少的是( )
| A. | 稀硫酸 | B. | 稀硝酸 | C. | 盐酸 | D. | 氢氧化钠溶液 |
8.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
15.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 在ZnS的白色浊液中滴几滴CuSO4溶液 | 探究Ksp(ZnS)和Ksp(CuS)的相对大小 |
| B | 用pH试纸分别测定等浓度的NaF、NaClO溶液的pH | 探究HF与HClO的电离常数 |
| C | 取少量硝酸亚铁溶液,滴加盐酸和KSCN溶液 | 探究硝酸亚铁是否变质 |
| D | 在CH2=CHCH2OH中滴加酸性高锰酸钾溶液,振荡 | 检验丙烯醇是否具有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
12.已知S(s)=S(g)△H1,S(g)+O2(g)═SO2(g)△H2,则S(s)燃烧的热化学方程式为( )
| A. | S(s)+O2(g)═SO2(g)△H=△H2-△H1 | |
| B. | S(s)+O2(g)═SO2(g)△H=△H1-△H2 | |
| C. | S(s)+O2(g)═SO2(g)△H=△H2+△H1 | |
| D. | 1molS(s)燃烧生成1molSO2(g)放出的热量大于1molS(g)燃烧生成1molSO2(g)放出的热量 |
11.甲、乙两个电解池均以Pt为电极,且互相串联.甲池盛有CuSO4溶液,乙池中盛有一定量的某盐溶液.通电一段时间后,测得甲池电极质量增加0.64g,乙池电极上析出0.24g金属,则乙池中的溶质可能是( )
| A. | MgSO4 | B. | Al(NO3)3 | C. | CuSO4 | D. | Na2SO4 |