题目内容
如图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时d电极上产生气泡.

试回答:
(1)a为 极(填电极名称),a极上可观察到的现象是 ,c极的电极反应式为 ,
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 .
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了 mol气体,若b极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 .
(4)电解停止后加蒸馏水使A烧杯红的溶液体积仍为200mL,取这种溶液加入到25.00mL 0.1mol?L-1盐酸中,当加入31.25mL溶液时刚好沉淀完全.则电解前A烧杯中MNO3溶液的物质的量浓度为 .

试回答:
(1)a为
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了
(4)电解停止后加蒸馏水使A烧杯红的溶液体积仍为200mL,取这种溶液加入到25.00mL 0.1mol?L-1盐酸中,当加入31.25mL溶液时刚好沉淀完全.则电解前A烧杯中MNO3溶液的物质的量浓度为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,则b为阴极,所以a、c是阳极、d是阴极,a电极上氢氧根离子放电、c电极上碘离子放电;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2;根据放电顺序先放电的I-,接着是OH-放电,
(3)根据串联电路中以及电解池中阴、阳两极得失电子数目相等求出气体的物质的量和金属的物质的量,最后根据M=
求出金属的摩尔质量;
(4)先根据(3)求出已放电的M+的物质的量,然后根据剩余的溶液与HCl反应求出剩余的M+,两者相加得原溶液中的M+,的物质的量,最后带入公式C=
,求出电解前A烧杯中MNO3溶液的物质的量浓度.
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2;根据放电顺序先放电的I-,接着是OH-放电,
(3)根据串联电路中以及电解池中阴、阳两极得失电子数目相等求出气体的物质的量和金属的物质的量,最后根据M=
| m |
| n |
(4)先根据(3)求出已放电的M+的物质的量,然后根据剩余的溶液与HCl反应求出剩余的M+,两者相加得原溶液中的M+,的物质的量,最后带入公式C=
| n |
| V |
解答:
解:(1)b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,则b为阴极,所以a、c是阳极、d是阴极,a电极上氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,所以看到的现象是有无色气体生成,c电极上碘离子放电,电极反应式为2I--2e-=I2,故答案为:阳极;有无色气体生成;2I--2e-=I2;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后,
接着是OH-放电:4OH--4e=2H2O+O2↑,c极上的试管中收集到的气体为氧气,
故答案为:c极附近的溶液首先变成蓝色;4OH--4e=2H2O+O2↑;
(3)d极是溶液中氢离子放电:
2H++2e-=H2↑
0.004mol
a极上氢氧根离子放电:
4OH--4e=2H2O+O2↑
0.004mol 0.001mol
即氧气的物质的量为0.001mol
b极上氢氧根离子放电:M++e-=M
0.004mol 0.004mol
则金属的摩尔质量M=
=
=108g/mol,
故答案为:0.001;108.
(4)设稀释后溶液的浓度为X,根据反应:Cl-+M+=MCl↓
1 1
0.100 mol/L×0.025L X×0.03125L
1:1=(0.100 mol/L×0.025L):(X×0.03125L)
解得X=0.08mol?L-1
所以200mL电解停止后加蒸馏水稀释的溶液中,M+ 的物质的量为0.08mol?L-1×0.2L=0.016mol
则电解前A烧杯中MNO3溶液的M+ 物质的量=0.004mol+0.16mol=0.004mol+0.016mol=0.02mol
所以MNO3溶液的物质的量浓度=
mol/L=0.1mol/L,故答案为:0.1mol/L.
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后,
接着是OH-放电:4OH--4e=2H2O+O2↑,c极上的试管中收集到的气体为氧气,
故答案为:c极附近的溶液首先变成蓝色;4OH--4e=2H2O+O2↑;
(3)d极是溶液中氢离子放电:
2H++2e-=H2↑
0.004mol
| 0.0448L |
| 22.4L/mol |
a极上氢氧根离子放电:
4OH--4e=2H2O+O2↑
0.004mol 0.001mol
即氧气的物质的量为0.001mol
b极上氢氧根离子放电:M++e-=M
0.004mol 0.004mol
则金属的摩尔质量M=
| m |
| n |
| 0.432g |
| 0.004mol |
故答案为:0.001;108.
(4)设稀释后溶液的浓度为X,根据反应:Cl-+M+=MCl↓
1 1
0.100 mol/L×0.025L X×0.03125L
1:1=(0.100 mol/L×0.025L):(X×0.03125L)
解得X=0.08mol?L-1
所以200mL电解停止后加蒸馏水稀释的溶液中,M+ 的物质的量为0.08mol?L-1×0.2L=0.016mol
则电解前A烧杯中MNO3溶液的M+ 物质的量=0.004mol+0.16mol=0.004mol+0.016mol=0.02mol
所以MNO3溶液的物质的量浓度=
| 0.02mol |
| 0.2L |
点评:本题考查了电解池原理,根据各个电极上发生的反应再结合转移电子相等进行计算即可,注意c电极上生成无色气体原因,为易错点.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
在25℃时,某醋酸钠溶液的pH为10,下列说法正确的是( )
| A、由水电离出的OH-离子浓度约为1×10-10mol/L |
| B、溶液中存在CH3COOH分子 |
| C、溶液中C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| D、溶液中加入少量醋酸pH将增大 |
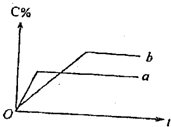 如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )
如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b表示没有使用催化剂 |
| B、其他条件相同,若只改变温度,则a比b的温度高且正反应吸热 |
| C、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D、其他条件相同,若只改变A物质的量,则a比b用A物质的量少 |
 已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,
已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,