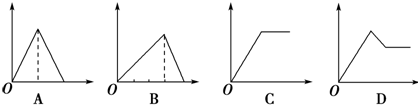
题目内容
15.如图四种常见实验操作,正确的是( )| A. |  固体的溶解 | B. |  流体的倾倒 | ||
| C. |  移走加热的蒸发皿 | D. |  读数 |
分析 A.溶解需要玻璃棒搅拌;
B.倾斜45°,口对口,标签正对手心,瓶塞倒放;
C.不能利用手拿,易烫伤;
D.图为仰视.
解答 解:A.溶解需要玻璃棒搅拌,搅拌加深溶解,故A错误;
B.倾斜45°,口对口,标签正对手心,瓶塞倒放,操作合理,故B正确;
C.不能利用手拿,易烫伤,应利用坩埚钳取,故C错误;
D.图为仰视,应使视线与凹液面的最低处相平,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、实验基本操作为解答的关键,侧重分析与实验能力的考查,注意实验技能、实验评价性分析,题目难度不大.

练习册系列答案
相关题目
6.现在甲基、羟基、羧基、苯基四种原子团,两两组合形成化合物,其水溶液呈酸性的有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.下列离子方程式正确的是( )
| A. | 向 AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OHˉ+HCO3-═CaCO3↓+H2O |
10.关于某溶液中所含离子的检验,下列判断正确的是( )
| A. | 加入BaCl2溶液生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- | |
| B. | 加入AgNO3溶液生成白色沉淀,则原溶液中一定含有Cl- | |
| C. | 加入KSCN溶液时,溶液不变红色,再滴入氯水溶液变为红色,则原溶液中一定含有Fe2+ | |
| D. | 加入盐酸,生成的气体能使成清石灰水变浑浊,则原溶液中一定含有CO32- |
20.常温下,下列关于各溶液的叙述中正确的是( )
| A. | 三种一元弱酸HX、HY、HZ,其电离平衡常数依次减小,则同体积同pH的对应钠盐溶液中,水的电离度大小是NaX>NaY>NaZ | |
| B. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)=c( H+)+c(CH3COOH) | |
| C. | 0.1mol/LNaHS溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c( S2-)>c(HS-)>c(OH-) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)=c( SO42-)>c(NH4+)>c(H+)=c(OH-) |
7.下列说法不正确的是( )
| A. | 按照系统命名法,烃分子 的名称为2,3-二甲基-3-乙基戊烷 的名称为2,3-二甲基-3-乙基戊烷 | |
| B. | 鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出 | |
| C. | 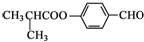 可发生加成反应、取代反应、氧化反应 可发生加成反应、取代反应、氧化反应 | |
| D. | 有机物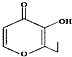 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 |
4.下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑤⑦ | D. | ④⑥⑦⑧ |
5.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| B. | 将0.5 mol/L的Na2CO3溶液与amol/L的NaHCO3溶液等体积混合,c(Na+)<c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 25℃某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |