题目内容
如图所示三套实验装置,分别回答下列问题.
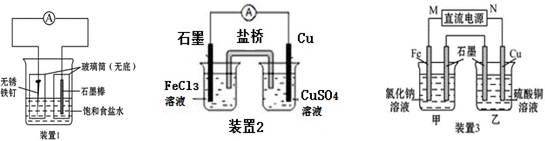
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是 极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2mol?L-1的NaCl溶液,乙烧杯盛放100mL 0.5mol?L-1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁为 极;甲烧杯中石墨电极的电极反应式为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为 mL.

(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为
(2)装置2中的铜是
(3)装置3中甲烧杯盛放100mL 0.2mol?L-1的NaCl溶液,乙烧杯盛放100mL 0.5mol?L-1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为
考点:原电池和电解池的工作原理
专题:
分析:(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-;
(2)形成原电池,总方程式为Cu+2Fe3+=Cu2++2Fe2+,根据总方程式判断;
(3)向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH-,应为电解池的阴极,则M为正极,N为负极,乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,结合电极方程式解答该题.
(2)形成原电池,总方程式为Cu+2Fe3+=Cu2++2Fe2+,根据总方程式判断;
(3)向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH-,应为电解池的阴极,则M为正极,N为负极,乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,结合电极方程式解答该题.
解答:
解:(1)铁发生吸氧腐蚀,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:O2+4e-+2H2O-═4OH-;
(2)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+,形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e-=Fe2+,
故答案为:负; Fe3++e-=Fe2+;
(3)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,
①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH-,应为电解池的阴极,则M为正极,N为负极,铁为阳极,电解氯化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e-═H2,
故答案为:阳; 2H2O+2e -=H2↑+2OH-或2H++2e-═H2;
②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O
2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O
2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=
=0.224L,即224mL,
故答案为:224.
故答案为:O2+4e-+2H2O-═4OH-;
(2)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+,形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e-=Fe2+,
故答案为:负; Fe3++e-=Fe2+;
(3)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,
①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH-,应为电解池的阴极,则M为正极,N为负极,铁为阳极,电解氯化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e-═H2,
故答案为:阳; 2H2O+2e -=H2↑+2OH-或2H++2e-═H2;
②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O
| ||
故答案为:2Cu2++2H2O
| ||
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
| 0.64g |
| 64g/mol |
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=
| 22.4L×0.02mol |
| 2mol |
故答案为:224.
点评:本题考查电化学知识,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算.

练习册系列答案
相关题目
下列各表述与示意图不一致的是( )
A、 图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol?L-1 |
B、 图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时, △H<0,若使用正催化剂,E值会减小 |
C、 图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、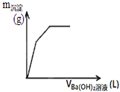 图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
有一种纸质软电池,采用薄层纸片作为载体和传导体,一面附着锌,另一面附着二氧化锰.电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),关于此电池,下列说法中正确的是( )
| A、该电池Zn为负极,发生还原反应 |
| B、该电池的正极反应为MnO2+e-+H2O=MnO(OH)+OH- |
| C、放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D、电池工作时OH-通过薄层纸片向附着二氧化锰的电极移动 |
25℃时0.1mol?L-1的下列溶液中,NH4+离子的浓度最小的是( )
| A、NH4Cl |
| B、NH4HSO4 |
| C、CH3COONH4 |
| D、(NH4)2SO4 |
向Mg、Al、Fe三种金属粉末状混合物中,加入过量盐酸充分反应,过滤后向滤液中加入过量NaOH溶液充分反应,再过滤后滤液中存在的离子有( )
| A、Al3+ |
| B、Cu2+ |
| C、Mg2+ |
| D、AlO2- |
用18mol/L H2SO4溶液和100mL容量瓶配置1.8mol/L H2SO4溶液,下列有关说法正确的是( )
| A、将10mL 18mol/L H2SO4溶液加入盛有90mL水的容量瓶中 |
| B、将10mL 18mol/L H2SO4溶液加入容量瓶中,加水至刻度线 |
| C、加水时不慎超过刻度线,立即用胶头滴管吸出多余液体 |
| D、定容时仰视刻度线,配置的溶液浓度偏小 |


 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式:
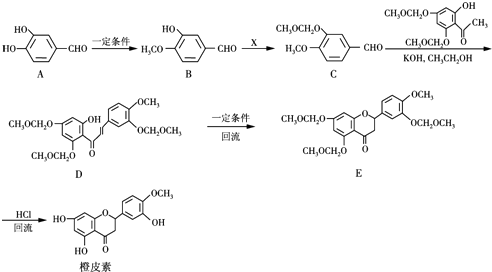
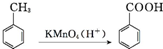 ,结合流程信息,写出以甲苯和上述流程中的“X”为原料,制备
,结合流程信息,写出以甲苯和上述流程中的“X”为原料,制备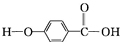 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).