题目内容
下列各表述与示意图不一致的是( )
A、 图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol?L-1 |
B、 图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时, △H<0,若使用正催化剂,E值会减小 |
C、 图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
D、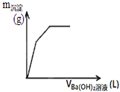 图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
考点:离子方程式的有关计算,化学反应的能量变化规律
专题:
分析:A、据图可知,0-25mLNaOH溶液的作用是沉淀Mg2+、Al3+,25mL-35mLNaOH溶液的作用是反应NH4+,35mL-45mLNaOH溶液的作用是溶解Al(OH)3,故最后剩余的沉淀是Mg(OH)2,即Mg(OH)2的物质的量为0.05mol,根据镁的守恒,即最初溶液中Mg2+的物质的量为0.05mol,设出溶液中Al3+、NH4+的物质的量,并设出NaOH的物质的量浓度,列式解答即可;
B、反应物的总能量大于生成物的总能量,为放热反应;E为活化能,使用催化剂,降低反应所需的活化能,而△H不变;
C、向用盐酸酸化的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟盐酸的H+发生中和反应;若OH-先和Mg2+产生沉淀Mg(OH)2,由于HCl的存在,HCl能将生成Mg(OH)2溶解,故OH-先跟盐酸的H+反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀.
D、先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分(5mol→4mol).
B、反应物的总能量大于生成物的总能量,为放热反应;E为活化能,使用催化剂,降低反应所需的活化能,而△H不变;
C、向用盐酸酸化的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟盐酸的H+发生中和反应;若OH-先和Mg2+产生沉淀Mg(OH)2,由于HCl的存在,HCl能将生成Mg(OH)2溶解,故OH-先跟盐酸的H+反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀.
D、先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分(5mol→4mol).
解答:
解:A、设出溶液中Al3+、NH4+的物质的量分别为Xmol和Ymol,设NaOH的物质的量浓度为Zmol/L.
据图可知,0-25mLNaOH溶液的作用是沉淀Mg2+、Al3+,故有:0.05mol×2+Xmol×3=0.025L×Zmol/L ①
25mL-35mLNaOH溶液的作用是反应NH4+,故有:Ymol=0.01L×Zmol/L ②
35mL-45mLNaOH溶液的作用是溶解Al(OH)3,故有:Xmol=0.005L×Zmol/L ③
解①②③可得:X=0.05mol Y=0.1mol Z=10mol/L
故溶液中n(Mg2+):n(Al3+):n( NH4+)=0.05:0.05:0.1=1:1:2,氢氧化钠溶液的浓度为10mol/L,故A错误;
B、图中曲线表示某反应过程的能量变化,若使用催化剂,降低反应所需的活化能,而△H不变,即E值会减小,故B正确;
C、第一段沉淀是BaSO4,SO42-完全反应虽然产生BaSO4同时OH-和H+反应,但是SO42-完全反应后,HCl仍过量,所以第二段曲线平直,Ba(OH)2在和HCl反应Ba(OH)2在和HCl反应完全后Mg2+再和OH-反应产生沉淀,直至曲线平直Ba(OH)2过量不再产生沉淀.故C正确;
D、向一定质量的明矾溶液中滴加Ba(OH)2溶液时,先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分(5mol→4mol),故D正确;
故选A.
据图可知,0-25mLNaOH溶液的作用是沉淀Mg2+、Al3+,故有:0.05mol×2+Xmol×3=0.025L×Zmol/L ①
25mL-35mLNaOH溶液的作用是反应NH4+,故有:Ymol=0.01L×Zmol/L ②
35mL-45mLNaOH溶液的作用是溶解Al(OH)3,故有:Xmol=0.005L×Zmol/L ③
解①②③可得:X=0.05mol Y=0.1mol Z=10mol/L
故溶液中n(Mg2+):n(Al3+):n( NH4+)=0.05:0.05:0.1=1:1:2,氢氧化钠溶液的浓度为10mol/L,故A错误;
B、图中曲线表示某反应过程的能量变化,若使用催化剂,降低反应所需的活化能,而△H不变,即E值会减小,故B正确;
C、第一段沉淀是BaSO4,SO42-完全反应虽然产生BaSO4同时OH-和H+反应,但是SO42-完全反应后,HCl仍过量,所以第二段曲线平直,Ba(OH)2在和HCl反应Ba(OH)2在和HCl反应完全后Mg2+再和OH-反应产生沉淀,直至曲线平直Ba(OH)2过量不再产生沉淀.故C正确;
D、向一定质量的明矾溶液中滴加Ba(OH)2溶液时,先发生的反应是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,然后2Al(OH)3+K2SO4+Ba(OH)2=2KAlO2+BaSO4↓+H2O,即沉淀达最多后溶解一部分(5mol→4mol),故D正确;
故选A.
点评:本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,D选项沉淀质量和物质的量最大量的区别,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列关于摩尔质量的叙述正确的是( )
| A、氢气的摩尔质量是2 g |
| B、氢气的摩尔质量就是其相对分子质量 |
| C、氢的摩尔质量是2 g/mol |
| D、氢气的摩尔质量是2 g/mol |
打开盛头下列试剂瓶,有白雾现象的是( )
| A、浓硫酸 | B、浓硝酸 |
| C、稀硝酸 | D、浓盐酸 |
 如图是根据电解原理制成的“银电量计”,其原理是:通过测定其电解过程中附着在惰性电极上金属质量,计算通过电解池的电量,下列说法正确的是( )
如图是根据电解原理制成的“银电量计”,其原理是:通过测定其电解过程中附着在惰性电极上金属质量,计算通过电解池的电量,下列说法正确的是( )| A、电量计工作时银棒应与电源的负极相连 |
| B、电量计工作时溶液里的阴离子向阴极移动 |
| C、网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏高 |
| D、若得金属银的沉积量108.0mg,则电解过程中转移的电子书为0.002mol |
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol1-
则C(s)+H2O(g)=CO(g)+H2(g)△H为( )
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol1-
则C(s)+H2O(g)=CO(g)+H2(g)△H为( )
| A、-704.6 kJ?mol-1 |
| B、+262.6 kJ?mol-1 |
| C、-131.3 kJ?mol-1 |
| D、+131.3 kJ?mol-1 |
 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了.全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了.全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.