题目内容
1.一种气态烷烃与一种气态炔烃等体积混合,测得混合气体在标准状况下的密度为1.25g/L,则构成这种混合气体的烷烃和炔烃可能是( )| A. | 甲烷,丙炔 | B. | 甲烷,丁炔 | C. | 乙烷,乙炔 | D. | 乙烷,丙炔 |
分析 根据M=ρVm计算混合气体的平均摩尔质量,从而可知二者的平均相对分子质量,再根据等体积混合可知烷烃和炔烃的物质的量相等,据此可计算出该烷烃和炔烃分子的相对分子质量之和,然后结合选项进行判断.
解答 解:混合气体在标准状况下的密度为1.25g/L,则混合气体的平均摩尔质量为:1.25g/L×22.4L/mol=28g/mol,混合气体的平均相对分子质量为28,
由于是等体积混合,则该烷烃和炔烃的物质的量相等,则1分子该烷烃和1分子炔烃的相对分子质量之和为:28×2=56,
A.甲烷、丙炔的相对分子质量分别为16、40,二者之和为56,满足条件,故A正确;
B.甲烷、丁炔的相对分子质量分别为16、54,二者的相对分子质量之和为70,不满足条件,故B错误;
C.乙烷、乙炔的相对分子质量分别为30、26,二者的相对分子质量之和为56,满足条件,故C正确;
D.乙烷、丙炔的相对分子质量分别为30、40,二者的相对分子质量之和为70,不满足条件,故D错误;
故选AC.
点评 本题考查了有机物分子式确定的计算,题目难度不大,明确平均摩尔质量的含义及应用方法为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.X、Y、Z、W和N均是由短周期元素组成的五种化合物.已知五种化合物水溶液的焰色反应均呈黄色,Y、Z和N均由三种元素组成.请根据题目要求回答下列问题.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(3)下表为Y与Z实验的部分内容:
写出Y与稀硫酸反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O.
(4)写出含0.1mol Z的溶液与20mL 5mol•L-1的盐酸反应的离子反应式AlO2-+H2O+H+=Al(OH)3↓.实验③加热蒸发、灼烧得到的最终产物主要是Al2O3.
(5)化合物W和N可以相互转化:W$?_{CO_{2}+H_{2}O}^{△}$N.若有W和N•xH2O的混合物6.52g,加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为4.2g,N•xH2O的化学式为Na2CO3.7H2O.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(3)下表为Y与Z实验的部分内容:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
(4)写出含0.1mol Z的溶液与20mL 5mol•L-1的盐酸反应的离子反应式AlO2-+H2O+H+=Al(OH)3↓.实验③加热蒸发、灼烧得到的最终产物主要是Al2O3.
(5)化合物W和N可以相互转化:W$?_{CO_{2}+H_{2}O}^{△}$N.若有W和N•xH2O的混合物6.52g,加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为4.2g,N•xH2O的化学式为Na2CO3.7H2O.
12.下列有机物互为同分异构体的是( )
| A. | 乙烷和乙烯 | B. | 正丁烷和异丁烷 | C. | 乙醇和乙酸 | D. | 葡萄糖和淀粉 |
9.下列说法正确的是( )
| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
1.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol/LNaOH溶液滴定.下列说法正确的是( )
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 滴定达到终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 随着NaOH溶液的滴入,锥形瓶中的pH由小变大 |
18.若锌与稀硝酸反应时,其化学反应方程式为:4Zn+10HNO3=aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为( )
| A. | 4、1、5、NO2 | B. | 4、2、4、NO2 | C. | 4、1、3、NH4NO3 | D. | 4、3、5、NO |
19.如图是甲醇燃料电池工作的示意图1,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2,则下列说法错误的是( )
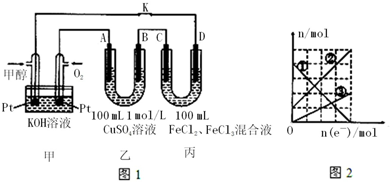

| A. | 负极的电极反应式是:CH3OH-6e-+8OH-═CO32-+6H2O | |
| B. | 乙中A极析出的气体在标准状况下的体积为1.12 L | |
| C. | 右图中②线表示的是Fe2+离子的变化 | |
| D. | 反应结束后,要使丙装置溶液中金属阳离子恰好完全沉淀,需要280 mL 5.0 mol/L NaOH溶液 |